
|
|
RESUMO DA AULA, CRIBS
Anestesiologia e reanimação. Folha de dicas: resumidamente, o mais importante
Diretório / Notas de aula, folhas de dicas Índice analítico
1. O conceito de ressuscitação A ressuscitação é um ramo da medicina clínica que estuda os problemas de revitalização do corpo, desenvolvendo princípios para a prevenção de condições terminais, métodos de ressuscitação e terapia intensiva. Os métodos práticos de revitalização do corpo estão unidos pelo conceito de "ressuscitação". Ressuscitação (do latim "revival" ou "animação") é um sistema de medidas destinadas a restaurar as funções vitais acentuadamente prejudicadas ou perdidas do corpo e removê-lo de um estado terminal e morte clínica. Medidas de ressuscitação eficazes são massagem cardíaca indireta e ventilação artificial dos pulmões. Se forem ineficazes em 30 minutos, a morte biológica é apurada. A terapia intensiva é um conjunto de medidas utilizadas para tratar condições graves, com risco de vida e envolve o uso de uma ampla gama de medidas terapêuticas, de acordo com as indicações, incluindo infusões intravenosas, ventilação mecânica prolongada, estimulação elétrica, métodos de diálise, etc. Um estado crítico é a impossibilidade de manter a integridade das funções do corpo como resultado de uma disfunção aguda de um órgão ou sistema, exigindo substituição de drogas ou instrumentos de hardware. O estado terminal é um estado limítrofe entre a vida e a morte, uma extinção reversível das funções do corpo, incluindo os estágios de pré-agonia, agonia e morte clínica. A morte clínica é uma condição terminal em que não há circulação sanguínea e respiração, a atividade do córtex cerebral é interrompida, mas os processos metabólicos são preservados. Com a morte clínica, a possibilidade de ressuscitação efetiva permanece. A duração da morte clínica é de 5 a 6 minutos. A morte biológica é uma cessação irreversível de processos fisiológicos em órgãos e tecidos, nos quais a ressuscitação é impossível. É estabelecido por uma combinação de vários sinais: ausência de movimentos espontâneos, contrações do coração e pulso nas grandes artérias, respiração, reações a estímulos dolorosos, reflexo da córnea, dilatação máxima da pupila e ausência de reação à luz. Sinais confiáveis do início da morte são uma diminuição da temperatura corporal para 20 C, o aparecimento de manchas cadavéricas e o rigor mortis muscular. 2. Manipulações básicas em terapia intensiva Punção percutânea e cateterização da veia principal (subclávia). Indicações: terapia de infusão-transfusão de grandes volumes, nutrição parenteral, terapia de desintoxicação, antibioticoterapia intravenosa, sondagem e contraste do coração, medição da PVC, implante de marcapasso, impossibilidade de cateterização de veias periféricas. Contra-indicações: violação do sistema de coagulação do sangue, processo inflamatório e purulento no local da punção e cateterismo, trauma na clavícula, síndrome da veia cava superior, síndrome de Paget-Schretter. Instrumentação e acessórios para punção e cateterismo: agulha de punção, conjunto de cateteres plásticos, conjunto de condutores, seringa de 10 ml para injeções intramusculares, tesoura, porta-agulha, agulha cirúrgica e ligadura de seda, esparadrapo. Técnica: a cateterização é realizada de acordo com as normas de assepsia e antissepsia, tratamento das mãos do operador, campo operatório e acondicionamento com material estéril. A posição do paciente é horizontal de costas com os braços trazidos ao corpo e a lapela da cabeça na direção oposta. A anestesia local é usada - solução de novocaína a 0,5-1%. A punção é melhor feita à direita, pois ao perfurar a veia subclávia esquerda, existe o perigo de danificar o ducto linfático torácico. Ponto de punção - na borda do terço interno e médio da clavícula 2 cm abaixo dela. A agulha é passada lentamente em um ângulo de 45 para a clavícula e 30-40 para a superfície do tórax entre a clavícula e a 15ª costela na direção da borda superior da articulação esternoclavicular. Ao passar a agulha, o êmbolo da seringa é apertado periodicamente para determinar se entra na veia e a novocaína é injetada ao longo da agulha. Ao perfurar uma veia, às vezes há uma sensação de fracasso. Depois de entrar na veia, a seringa é desconectada da agulha e a cânula é fechada com o dedo. Em seguida, um condutor é inserido através da agulha até um comprimento de 20-6 cm e a agulha é removida. Um cateter de diâmetro apropriado é passado através do condutor e, juntamente com o condutor, é inserido na veia por 8-2 cm, após o que o condutor é cuidadosamente removido. Para verificar a posição correta do cateter, uma seringa é anexada a ele e 3-3 ml de sangue são aspirados, após o que um plugue é colocado ou a terapia de infusão é iniciada. O cateter é fixado com uma ligadura de seda à pele. Para fazer isso, uma manga de esparadrapo é feita no cateter a 5-XNUMX mm da pele, na qual a seda é amarrada, depois passa pelas orelhas do cateter e amarrada novamente. Após a fixação do cateter, o local da punção é fechado com adesivo asséptico. Complicações: punção da artéria subclávia, embolia aérea, punção da cavidade pleural, lesão do plexo braquial, lesão do ducto linfático torácico, lesão da traqueia, bócio e glândula tireoide, supuração no local da punção. 3. Traqueostomia. Conicostomia Traqueostomia Indicações: obstrução da laringe e traqueia superior por obstrução por tumor ou corpo estranho, paralisia e espasmo das cordas vocais, edema grave da laringe, dificuldade respiratória aguda, aspiração de vômito, prevenção da asfixia em lesões torácicas graves. Ferramentas: 2 bisturis, 2 pinças anatômicas e cirúrgicas, várias pinças hemostáticas, um elevador, uma sonda ranhurada, 2 ganchos rombos e 1 monodentado, dilatador Trousseau ou Deschamps, agulhas cirúrgicas com porta-agulhas. Técnica. O paciente está deitado de costas, um rolo sob os ombros, a cabeça é jogada para trás. Se o paciente estiver em estado de asfixia, o rolo é colocado apenas no último momento, antes de abrir a traqueia. A anestesia por infiltração local é realizada com solução de novocaína a 0,5-1% com adição de adrenalina. Na asfixia aguda, é possível operar sem anestesia. Pontos de identificação: o ângulo da cartilagem tireóide e o tubérculo do arco da cartilagem cricóide. Uma incisão da pele, tecido subcutâneo e fáscia superficial é feita da borda inferior da cartilagem tireoide até a incisura jugular estritamente ao longo da linha média do pescoço. A veia mediana do pescoço é retraída ou ligada, encontrando uma linha branca, ao longo da qual os músculos são afastados de forma romba e o istmo da glândula tireoide é exposto. As bordas da incisão são afastadas com um dilatador de Trousseau, são aplicadas ligaduras na borda da ferida e o tubo de traqueostomia é inserido cuidadosamente, certificando-se de que sua extremidade entre no lúmen da traqueia. A ferida cirúrgica é suturada. O tubo é fixado no pescoço do paciente com uma tala de gaze, previamente amarrada à blindagem do tubo. Insira o tubo interno no tubo externo. Conicostomia O paciente é colocado de costas com um rolo transversal ao nível das omoplatas. A cabeça do paciente é inclinada para trás. A laringe é fixada com os dedos nas superfícies laterais da cartilagem tireoide e é sentida a lacuna entre a cartilagem tireoide e cricóide, onde está localizado o ligamento em forma de cone. Sob anestesia de infiltração local com um bisturi pontiagudo, é feita uma incisão transversal na pele de cerca de 2 cm de comprimento, o ligamento em forma de cone é palpado e dissecado ou perfurado. Qualquer cânula de traqueostomia de diâmetro adequado é inserida no orifício formado e fixada com uma tira de gaze ao redor do pescoço. Na ausência de uma cânula, ela pode ser substituída por um pedaço de borracha ou tubo plástico de diâmetro e comprimento adequados. Para evitar que este tubo deslize para dentro da traqueia, sua extremidade externa é perfurada transversalmente a uma distância de 2 cm da borda e fixada com uma tira de gaze. Conicotome é uma cânula de traqueostomia de metal de pequeno diâmetro com um mandril perfurante dentro dela. Após a dissecção da pele acima do ligamento em forma de cone, ela é perfurada com um conicótomo, o mandrina é removido e a cânula é colocada em uma posição que garanta o livre fluxo de ar na traqueia e fixada. 4. Intubação traqueal Indicações: estreitamento da laringe, respiração patológica, insuficiência respiratória aguda, coma II e III grau, alto risco de aspiração durante intervenções cirúrgicas nos órgãos do tórax e cavidade abdominal, cabeça e pescoço, em doenças da faringe, laringe e traqueia (inflamação aguda, câncer, tuberculose e etc.). Um laringoscópio é usado para intubação. É composto por um cabo e uma lâmina. As lâminas curvas mais utilizadas, pois são mais fisiológicas. Lâminas retas são usadas com um pescoço longo. A preparação para a intubação inclui a verificação do equipamento e o posicionamento correto do paciente. O tubo endotraqueal deve ser verificado. O manguito é testado inflando-o com uma seringa de 10 ml. Verifique o contato da lâmina com o cabo do laringoscópio e a lâmpada. É necessário garantir que a sucção esteja pronta em caso de descarga repentina de escarro, sangramento ou vômito. A intubação bem sucedida depende da posição correta do paciente. A cabeça do paciente deve estar no nível do processo xifóide do intubador. A elevação moderada da cabeça com extensão simultânea na articulação atlantooccipital cria uma melhor posição para intubação. A preparação para a intubação também inclui a pré-oxigenação obrigatória. O laringoscópio é segurado na mão não dominante (para a maioria das pessoas, esta é a esquerda), e a boca do paciente é bem aberta com a outra mão. A lâmina é inserida ao longo do lado direito da orofaringe, evitando danos aos dentes. A língua é deslocada para a esquerda e a lâmina é levantada até o arco da faringe. A ponta de uma lâmina curva é inserida na valécula (uma fossa localizada na superfície anterior da epiglote), enquanto a ponta de uma lâmina reta deve levantar a epiglote diretamente. O cabo do laringoscópio é empurrado para cima e para frente perpendicularmente à mandíbula até que as cordas vocais apareçam. A dependência dos dentes deve ser evitada. O tubo endotraqueal é retirado na mão direita e passado pela glote aberta sob controle visual. O manguito deve ser posicionado na traqueia superior, mas abaixo da laringe. O laringoscópio é removido da boca, novamente evitando danos aos dentes. Imediatamente após a intubação, a auscultação é realizada nos pulmões em ambos os lados (uma vez que é possível passar um tubo em um brônquio) e no epigástrio (para excluir a intubação esofágica). Se o tubo estiver na traqueia, ele é fixado na posição com fitas e o balonete é inflado. O manguito deve ser posicionado acima do nível da cartilagem cricóide, pois a permanência prolongada na laringe pode levar à rouquidão no pós-operatório. Complicações: intubação do esôfago, brônquio, localização do manguito na laringe, danos nos dentes, luxação da mandíbula, laringoespasmo, distúrbios reflexos (hipertensão, taquicardia, aumento da pressão intracraniana), lesão do trato respiratório, inflamação, etc. 5. Punção e cateterização do espaço peridural Indicações: síndrome da dor intensa, intervenções cirúrgicas, proporcionando analgesia pós-operatória. O nível de configuração do bloqueio peridural depende de qual órgão precisa ser anestesiado. Níveis da coluna vertebral e "órgãos-alvo" na anestesia peridural
Instrumentação: agulhas para anestesia, agulha especial para punção do espaço peridural, seringa de amostra, cateter, plugue, esferas filtrantes, guardanapos, fita adesiva e luvas estéreis. A posição do paciente é sentado ou deitado de lado. Neste caso, os joelhos e o queixo devem ficar o mais próximo possível do peito. Assim, cria-se a máxima flexão da coluna, na qual o ângulo entre os processos espinhosos das vértebras adjacentes aumenta e a aproximação ao ligamento amarelo é facilitada. Sob condições assépticas e sob anestesia local com solução de novocaína a 0,5%, é realizada punção do espaço peridural. A agulha é injetada estritamente perpendicularmente, mas com osteocondrose, um ângulo de inclinação é possível ou durante a punção na região médio-torácica. Quando a agulha entra na espessura dos ligamentos, o mandrina é removido e uma seringa com líquido é anexada. O avanço adicional da agulha é realizado lenta e suavemente com pressão no êmbolo da seringa. Devido à resistência significativa dos ligamentos, o líquido não pode sair da seringa. A seringa é desconectada e o cateter é inserido 5-7 cm, não deve haver resistência. A agulha é retirada e o condutor é fixado na parte de trás com fita adesiva, trazendo-o para a superfície frontal do tórax. A ficha com o filtro é fixada ao condutor. Um anestésico é injetado. Depois disso, o nível de anestesia da pele é determinado. Complicações: distúrbios respiratórios e hemodinâmicos, intoxicação, danos à dura-máter, complicações neurológicas, peridurite. 6. Distúrbios agudos da consciência A consciência é a forma mais elevada de reflexão da realidade, que é um conjunto de processos mentais que permitem a uma pessoa navegar no mundo ao seu redor, o tempo, sua própria personalidade, que garante seu comportamento. O comprometimento da consciência é o nome geral para distúrbios da atividade integral do cérebro, expresso em uma violação da capacidade de perceber, compreender e responder adequadamente ao ambiente, navegar nele, lembrar de eventos atuais, fazer contato de fala e executar expedientes arbitrários. atos comportamentais. Existem várias opções para depressão da consciência (estupor, estupor, coma de várias profundidades), bem como confusão aguda (estado delirante ou encefalopatia metabólica). O grau de consciência prejudicada varia de confusão leve a coma, e não há transições claras entre esses estados. Na prática, o grau de consciência prejudicada é determinado pela reação do paciente aos estímulos. A estupefação é uma forma de consciência prejudicada, caracterizada por letargia, lentidão e dificuldade no curso dos processos mentais, rápida exaustão da atenção, aumento do limiar para a percepção de estímulos externos, mas mantendo contato verbal limitado. A estupefação é baseada em uma violação da atenção, ou seja, a capacidade de selecionar as informações necessárias e coordenar as respostas de tal forma que a sequência lógica de pensamentos e ações não seja violada. As causas mais comuns de estupor são distúrbios metabólicos e tóxicos, mas às vezes também é observado em lesões focais do córtex, especialmente no lobo parietal direito. Em tais pacientes, é possível obter uma resposta monossilábica ou a implementação das instruções mais simples somente após apelos persistentes ou estimulação adicional. Com mais opressão da consciência, a possibilidade de contato de fala é perdida e o sopor se desenvolve. Sopor é um estado de depressão profunda da consciência com a perda da possibilidade de contato com o paciente, mas a preservação de reações protetoras coordenadas e a abertura dos olhos do paciente em resposta à dor, som ou outros estímulos. O paciente não pode ser totalmente despertado mesmo com a ajuda de estímulos dolorosos, ele fica com os olhos fechados. A reação às instruções verbais é fraca ou completamente ausente, é impossível obter uma palavra ou som de resposta do paciente. Com mais opressão da consciência, desenvolve-se um coma. O coma é um estado inconsciente caracterizado pela insensibilidade a estímulos externos. Este é um estado de depressão das funções do sistema nervoso central com risco de vida e distúrbios da regulação das funções vitais. O coma pode ser causado por diversos distúrbios metabólicos e danos estruturais. 7. Exame de um paciente em coma O plano de exame do paciente é o seguinte. 1. Avaliação do estado funcional dos sistemas respiratório e cardiovascular. 2. Exames clínicos gerais, tendo em conta os dados laboratoriais, permitindo avaliar a patologia extracraniana. 3. Exame neurológico. Exames laboratoriais: exame clínico geral de sangue (sinais de infecção bacteriana ou viral); química do sangue: glicose, fatores de coagulação (tempo de coagulação, protrombina, fibrinogênio, APTT, antitrombina III, testes de paracoagulação, contagem de plaquetas), uréia, creatinina, bilirrubina, ALT, AST, osmolaridade, eletrólitos (K, Na, Mg, Ca); triagem toxicológica de sangue, urina, conteúdo gástrico. Estudos instrumentais: radiografia de crânio e coluna cervical. A consulta de um neuropatologista (neurocirurgião) determina a direção adicional da busca diagnóstica: ressonância magnética ou computadorizada; EEG; dopplerografia ultrassônica. Punção lombar com análise do líquido cefalorraquidiano é obrigatória após: 1) consulta com oftalmologista e exclusão de sinais de aumento da pressão intracraniana - edema e elevação dos discos ópticos; 2) exclusão de sinais de herniação do cérebro. As seguintes localizações da hérnia do cérebro são distinguidas. Herniação diencefálica, que ocorre quando a localização supratentorial medial é lesada e consiste no deslocamento do diencéfalo através da incisura da espiga cerebelar. Este processo chama: 1) respiração de Cheyne-Stokes; 2) constrição das pupilas mantendo sua reação à luz; 3) paralisia do olhar para cima; 4) alterações no estado mental. A herniação das partes mediais do lobo temporal, que ocorre quando a localização supratentorial lateral é afetada, consiste no deslocamento das partes mediais do lobo temporal através da incisura da espiga cerebelar. A pressão resultante nas estruturas do mesencéfalo é manifestada por: 1) consciência prejudicada; 2) pupila aumentada e não reativa no lado da hérnia, que está associada à compressão do III nervo craniano; 3) hemiparesia do lado oposto. Os movimentos dos globos oculares nem sempre são perturbados. Herniação das amígdalas do cerebelo, que é causada pela pressão que empurra a parte inferior do cerebelo através do forame magno, o que leva à compressão da medula oblonga. Causa: 1) consciência prejudicada; 2) violações do ritmo respiratório ou apnéia. 8. Tratamento do coma O tratamento deve ser o mais agressivo possível e visa principalmente garantir a oxigenação adequada e estabilização da hemodinâmica central. Se a respiração espontânea for mantida, recomenda-se a insuflação de oxigênio umidificado por meio de máscara ou cateter nasal. Na ausência de respiração espontânea ou na presença de respiração patológica, é realizada intubação traqueal e o paciente é transferido para ventilação pulmonar artificial. Com agitação psicomotora e reação à ventilação mecânica, é necessário o uso de sedativos (benzodiazepínicos, butirofenonas). A estabilização da hemodinâmica central é a normalização da pressão arterial. Em um estado hipertensivo, a pressão arterial deve ser reduzida, mas não mais que 10% da original por hora. Um bom efeito é o uso de nitroprussiato de sódio ou sulfato de magnésio. Com hipotensão, são utilizados dopamina, dopamina, dobutrex e medicamentos hormonais. Na ausência de dados anamnésicos e diagnóstico incerto, a terapia exjuvantibus é realizada (uma resposta positiva à exposição à droga, por um lado, dá a chave para o diagnóstico, por outro, ajuda a ganhar tempo para evitar alterações irreversíveis) : 1) tiamina - 100 mg por via intravenosa, posteriormente - 100 mg por via intramuscular (especialmente se houver histórico de alcoolismo, ao determinar altas concentrações de etanol no sangue); 2) glicose - uma solução a 40% de 60 ml por via intravenosa (com um nível desconhecido de glicose no plasma ou em um nível inferior a 3 mmol / l); 3) naloxona - 0,4-1,2 mg por via intravenosa, fracionada, repetidamente, especialmente na presença de "sinais de opiáceos" (traços de injeções intravenosas, pupilas estreitas, distúrbios respiratórios centrais); 4) anexat (flumazenil) - 0,2 mg por 30 segundos, no minuto seguinte, introduzir mais 0,3 mg, a cada minuto seguinte - 0,5 mg para uma dose total de 3 mg. Na ausência de um efeito, pode-se supor que o coma provavelmente não seja causado por benzodiazepínicos; 5) em caso de intoxicação ou superdosagem com droga ou substância conhecida, é necessário administrar o antídoto adequado (se houver possibilidade de terapia com antídoto). O tratamento é realizado: 1) controle da síndrome convulsiva; 2) manutenção da normotermia; 3) prevenção de aspiração de conteúdos gástricos; 4) tratamento urológico; 5) diminuição da pressão intracraniana. 9. Ressuscitação cardiopulmonar A ressuscitação cardiopulmonar (RCP) é um complexo de medidas cirúrgicas e terapêuticas realizadas na ausência de lesões com risco de vida e destinadas a restaurar e apoiar a função do sistema cardiorrespiratório. Indicações para ressuscitação cardiopulmonar: realizada em pacientes sem pulso efetivo nas artérias carótidas ou pulso filiforme, fraco, inconscientes e (ou) na ausência de movimentos respiratórios efetivos. Os casos mais comuns de parada cardíaca primária, bem como insuficiência respiratória primária. Contra-indicações: traumas incompatíveis com a vida, estágios terminais de doenças incuráveis e morte biológica. Princípios básicos Os esforços primários em RCP visam: 1) compressão torácica; 2) sopro de ar nos pulmões e ventilação; 3) preparo e administração de medicamentos; 4) instalação e manutenção de acesso intravenoso; 5) atividades especializadas (desfibrilação, instalação de marcapasso, intubação traqueal). Assim, para completar todo o escopo de atividades, são necessárias 4 pessoas e um líder de equipe. Uma pessoa deve ser responsável pela RCP. Essa pessoa deve integrar todas as informações disponíveis e priorizar o impacto. Ele deve monitorar o monitor de ECG, o uso de medicamentos e garantir que as ações dos demais membros da equipe sejam corrigidas. Ele deve ser afastado do desempenho de procedimentos que prejudiquem o papel de liderança. Por mais de 40 anos, o alfabeto de ressuscitação Safar tem sido usado para RCP. Nesse complexo, a sequência de ações do ressuscitador é mantida; de acordo com o nome em inglês, são indicadas pelas letras correspondentes. A - Via aérea - garantindo a permeabilidade das vias aéreas. B - Respiração - ventilação artificial dos pulmões (ALV) de forma acessível, por exemplo, ao respirar "boca a boca". C - Circulação - garantindo a hemocirculação - massagem cardíaca indireta. D - Drogas - a introdução de drogas. E - Eletrocardiografia - registro de ECG. F - Fibrilação - realização, se necessário, de desfibrilação elétrica (cardioversão). G - Aferição - avaliação dos resultados primários. H - Hipotermia - resfriamento da cabeça. I - Terapia intensiva - terapia intensiva para síndromes pós-ressuscitação. 10. Garantir a permeabilidade do trato respiratório. IVL A - Via aérea - gestão das vias aéreas O paciente é colocado horizontalmente de costas. A cabeça é jogada para trás o máximo possível. Se um paciente com tônus muscular reduzido estiver deitado de costas, sua língua pode afundar, como se estivesse apertando a garganta. Ao mesmo tempo, a epiglote desce, bloqueando ainda mais as vias aéreas. Aparecem: respiração sonora, depois violações do ritmo respiratório até sua parada completa. Tais fenômenos se desenvolvem especialmente rapidamente em pacientes inconscientes. Para prevenir e eliminar a retração da língua, a mandíbula inferior deve ser trazida para frente e, ao mesmo tempo, deve ser realizada hiperextensão na articulação occipito-cervical. Para isso, com a pressão dos polegares no queixo, a mandíbula do paciente é deslocada para baixo e, em seguida, com os dedos colocados nos cantos da mandíbula, eles a empurram para frente, complementando essa técnica com a superextensão da cabeça para trás ( técnica tripla de Safar). Com a conduta correta e oportuna dessas manipulações, a permeabilidade das vias aéreas ao nível da faringe é rapidamente restaurada. A causa da obstrução das vias aéreas pode ser corpos estranhos. Eles são rapidamente removidos com qualquer material improvisado (guardanapo). A cabeça do paciente deve ser virada para o lado devido ao perigo de aspiração. A restauração da permeabilidade do trato respiratório superior é facilitada pelo uso de vários dutos de ar. O mais conveniente é o uso de um duto de ar em forma de S. Para sua introdução, a boca do paciente é aberta com os dedos cruzados II e I, e o tubo é avançado até a raiz da língua para que sua abertura "deslize" ao longo do palato. Deve-se tomar cuidado para garantir que o duto de ar não se mova durante o transporte. Se todos os procedimentos descritos não forem eficazes, podemos supor a presença de obturação das vias aéreas nas seções subjacentes. Nesses casos, é necessária laringoscopia direta e aspiração ativa de secreção patológica, seguida de intubação traqueal por 10-15 segundos. É aconselhável realizar conicotomia e traqueostomia. B - Respiração - ventilação pulmonar artificial (ALV) de forma acessível O método mais simples e eficaz de respiração artificial durante a ressuscitação é o método boca-a-boca. Após 2-3 insuflações dos pulmões, é determinada a presença de um pulso na artéria carótida; se não for detectado, eles prosseguem para a restauração artificial da circulação sanguínea. A ventilação manual é utilizada com bolsa auto-expansível do tipo Ambu. Ao usar um ventilador, a frequência respiratória é de 12 a 15 por minuto, o volume inspiratório é de 0,5 a 1,0 litros. Em um hospital, a intubação traqueal é realizada e o paciente é transferido para um ventilador. 11. Massagem cardíaca indireta C-Circulação - garantindo a hemocirculação - compressões torácicas A massagem cardíaca fechada é a forma mais simples e eficiente de suporte circulatório artificial de emergência. A massagem cardíaca fechada deve ser iniciada imediatamente, tão logo seja feito o diagnóstico de parada circulatória aguda, sem esclarecer suas causas e mecanismos. Em casos de contrações cardíacas ineficazes, não se deve esperar por uma parada cardíaca completa ou uma restauração independente da atividade cardíaca adequada. Regras básicas para massagem cardíaca fechada. 1. O paciente deve estar em posição horizontal sobre uma base sólida (piso ou maca baixa) para evitar a possibilidade de deslocamento de seu corpo sob o fortalecimento das mãos massageadoras. 2. A zona de aplicação da força das mãos do reanimador localiza-se no terço inferior do esterno, estritamente ao longo da linha média; o ressuscitador pode estar em ambos os lados do paciente. 3. Para massagem, uma palma é colocada em cima da outra e a pressão é aplicada no esterno na área localizada 3-4 dedos transversais acima do local de fixação ao esterno do processo xifóide; as mãos do massageador, endireitadas nas articulações do cotovelo, são posicionadas de forma que apenas o pulso produza pressão. 4. A compressão do tórax da vítima é realizada devido à gravidade do torso do médico. O deslocamento do esterno em direção à coluna (ou seja, a profundidade da deflexão do tórax) deve ser de 4-6 cm. 5. A duração de uma compressão torácica é de 0,5 s, o intervalo entre as compressões individuais é de 0,5-1 s. Taxa de massagem - 60 movimentos de massagem por minuto. Nos intervalos, as mãos não são removidas do esterno, os dedos permanecem levantados, os braços são totalmente estendidos nas articulações do cotovelo. Quando a ressuscitação é realizada por uma pessoa, após duas rápidas injeções de ar nos pulmões do paciente, são realizadas 15 compressões torácicas, ou seja, a proporção "ventilação: massagem" é 2: 15. Se 2 pessoas estão envolvidas na ressuscitação, então esta relação é de 1:5, ou seja, há 5 compressões torácicas por respiração. Um pré-requisito para a massagem cardíaca é o monitoramento constante de sua eficácia. Os critérios para a eficácia da massagem devem ser considerados da seguinte forma. 1. Alteração da cor da pele: torna-se menos pálida, cinzenta, cianótica. 2. Constrição das pupilas, se dilatadas, com aparência de reação à luz. 3. O aparecimento de um impulso de pulso nas artérias carótidas e femorais e, às vezes, na artéria radial. 4. Determinação da pressão arterial ao nível de 60-70 mm Hg. Arte. quando medido no ombro. 5. Às vezes, o aparecimento de movimentos respiratórios independentes. 12. A introdução de drogas. Registro de ECG D - Drogas - a introdução de drogas. Em caso de cessação aguda da circulação sanguínea, a introdução de agentes que estimulem a atividade cardíaca deve começar o mais rápido possível, se necessário, ser repetida durante a ressuscitação. Após o início da massagem cardíaca, 0,5-1 ml de adrenalina deve ser injetado o mais rápido possível (por via intravenosa ou intratraqueal). Suas introduções repetidas são possíveis após 2-5 minutos (até 5-6 ml no total). Com assistolia, a adrenalina tonifica o miocárdio e ajuda a "iniciar" o coração, com fibrilação ventricular contribui para a transição da fibrilação de ondas pequenas para ondas grandes, o que facilita muito a desfibrilação. A adrenalina facilita o fluxo sanguíneo coronário e aumenta a contratilidade do músculo cardíaco. Em vez de epinefrina, pode-se usar isodrina, que é 3 vezes mais eficaz que a adrenalina em termos de eficácia do efeito no miocárdio. A dose inicial é de 1-2 ml por injeção intravenosa, e os próximos 1-2 ml em 250 ml de uma solução de glicose a 5%. Em condições de circulação sanguínea prejudicada, a acidose metabólica aumenta progressivamente, portanto, imediatamente após a infusão de adrenalina, uma solução de bicarbonato de sódio a 4-5% é administrada por via intravenosa na taxa de 3 ml/kg do peso corporal do paciente. No processo de morte, o tom do sistema nervoso parassimpático aumenta significativamente, o cérebro está esgotado, portanto, os M-colinolíticos são usados. Com assistolia e bradicardia, a atropina é administrada por via intravenosa em uma solução a 0,1% - 0,5-1 ml, até uma dose máxima de 3-4 ml. Para aumentar o tônus miocárdico e reduzir o efeito da hipercalemia, recomenda-se a administração intravenosa de 5 ml de uma solução de cloreto de cálcio a 10%. Adrenalina, atropina e cloreto de cálcio podem ser administrados juntos na mesma seringa. Com taquicardia grave e principalmente com o desenvolvimento de fibrilação, é indicado o uso de lidocaína na dose de 60-80 mg, mas como é de ação curta, é infundida a uma taxa de 2 mg / min. Também está indicado o uso de glicocorticóides, que, ao aumentar a sensibilidade das estruturas miocárdicas adrenoreativas às catecolaminas e normalizar a permeabilidade das membranas celulares, contribuem para o restabelecimento da atividade cardíaca adequada. E - Eletrocardiografia - registro de ECG Com a ajuda de um estudo de ECG, é determinada a natureza da violação da atividade cardíaca. Na maioria das vezes, pode ser assistolia - cessação completa das contrações cardíacas, fibrilação - contração caótica e descoordenada das fibras miocárdicas com uma frequência de 400-500 batimentos / min, na qual o débito cardíaco praticamente para. Inicialmente, observa-se fibrilação de ondas grandes, que, em 1-2 minutos, passa para fibrilação de ondas pequenas, seguida de assistolia. A presença de qualquer ritmo no ECG é melhor do que a completa ausência de atividade elétrica do miocárdio. Portanto, a principal tarefa da RCP é estimular a atividade elétrica do miocárdio e, posteriormente, modificá-la para um ritmo efetivo (presença de pulso). 13. Desfibrilação elétrica F - Fibrilação - realizando, se necessário, desfibrilação elétrica (cardioversão) A fibrilação cardíaca pode ser eliminada pelo uso de desfibrilação elétrica. É necessário aplicar eletrodos firmemente ao tórax (na posição anterolateral, um eletrodo está localizado na região do ápice do coração, o segundo na região subclávia à direita do esterno), o que aumenta a força do descarga e, consequentemente, a eficácia da desfibrilação. Em vários pacientes, a posição anteroposterior (ápice do coração - espaço interescapular) dos eletrodos é mais eficaz. Não aplique eletrodos sobre as sobreposições do monitor de ECG. Deve-se notar que a desfibrilação elétrica é efetiva somente quando oscilações de ondas grandes com amplitude de 0,5 a 1 mV ou mais são registradas no ECG. Esse tipo de fibrilação miocárdica indica a segurança de seus recursos energéticos e a possibilidade de restabelecer a atividade cardíaca adequada. Se as oscilações forem baixas, arrítmicas e polimórficas, o que é observado na hipóxia miocárdica grave, a possibilidade de restaurar a atividade cardíaca após a desfibrilação é mínima. Neste caso, com a ajuda de massagem cardíaca, ventilação mecânica, administração intravenosa de adrenalina, atropina, cloreto de cálcio, é necessário realizar a transferência da fibrilação para ondas grandes, e somente depois disso deve ser realizada a desfibrilação. A primeira tentativa de desfibrilação é realizada com uma descarga de 200 J, com tentativas subsequentes a carga aumenta para 360 J. Os eletrodos devem ser umedecidos e pressionados firmemente contra a superfície do tórax. Os erros mais comuns durante a desfibrilação, que causam a ineficácia desta última, incluem o seguinte. 1. Longas pausas na massagem cardíaca ou ausência completa de reanimação durante a preparação do desfibrilador para a alta. 2. Pressão frouxa ou umedecimento insuficiente dos eletrodos. 3. Aplicação de uma descarga no contexto de fibrilação de ondas baixas sem tomar medidas que aumentem os recursos energéticos do miocárdio. 4. Aplicando uma descarga de baixa ou excessivamente alta tensão. Deve-se notar que a desfibrilação elétrica do coração é um método eficaz para corrigir arritmias cardíacas como taquicardia ventricular paroxística, flutter atrial, taquicardia nodal e supraventricular, fibrilação atrial. A indicação de desfibrilação elétrica, na fase pré-hospitalar, é na maioria das vezes a taquicardia ventricular paroxística. Uma característica da desfibrilação nessas condições é a presença de consciência no paciente e a necessidade de eliminar a reação à dor ao aplicar uma descarga elétrica. 14. Cuidados intensivos de síndromes pós-ressuscitação I-Cuidados intensivos - cuidados intensivos para síndromes pós-ressuscitação 1. Correção de CBS e equilíbrio hidroeletrolítico. Frequentemente, após a RCP, desenvolvem-se alcalose metabólica, hipocalemia, hipocloremia e outros distúrbios eletrolíticos. Há uma mudança no pH para um ambiente ácido ou alcalino. A chave para a correção do pH é a ventilação adequada. O uso de bicarbonato deve ser realizado sob o controle da composição gasosa do sangue. Como regra, não há necessidade de introdução de HCO3 com uma rápida restauração da circulação sanguínea e da respiração. Com um coração funcionando, um nível de pH de ~ 7,15 é adequado para o funcionamento do sistema cardiovascular. 2. Normalização do sistema de defesa antioxidante. A terapia intensiva inclui um complexo de drogas antioxidantes com ação multidirecional - mafusol, unitiol, vitamina C, multibionte, tocoferol, probucol, etc. 3. O uso de antioxidantes auxilia na redução da intensidade dos processos metabólicos e, consequentemente, na redução da necessidade de oxigênio e energia, bem como no aproveitamento máximo da reduzida quantidade de oxigênio disponível durante a hipóxia. Isto é conseguido através do uso de drogas de proteção neurovegetativa e anti-hipoxantes (seduxen, droperidol, bloqueadores ganglionares, mexamina, oxibutirato de sódio, citocromo, gutimina, etc.). 4. O aumento dos recursos energéticos é proporcionado pela administração intravenosa de soluções concentradas de glicose com insulina e as principais coenzimas envolvidas na utilização de energia (vitamina B6, cocarboxilase, ATP, riboxina, etc.). 5. A estimulação da síntese de proteínas e ácidos nucléicos - substratos absolutamente necessários para o funcionamento normal das células, a síntese de enzimas, imunoglobulinas e outros, é realizada pelo uso de hormônios anabólicos (retabolil, nerabolil, insulina, retinol ), ácido fólico, bem como a introdução de soluções de aminoácidos. 6. A ativação do metabolismo aeróbico é alcançada introduzindo uma quantidade suficiente de substratos de oxidação (glicose), bem como usando oxigenação hiperbólica (HBO) - este método garante o fornecimento da quantidade necessária de oxigênio, mesmo em condições de violações acentuadas de sua entrega . 7. Melhoria dos processos redox (ácido succínico, riboxina, tocoferol, etc.). 8. A terapia de desintoxicação ativa contribui para a normalização dos processos metabólicos. Para isso, são utilizados vários métodos de terapia infusional (gelatinol, albumina, plasma), diurese forçada, etc. Em casos graves, métodos de desintoxicação extracorpórea (hemossorção, hemodiálise, plasmaférese) são utilizados. 9. Eliminação de violações dos processos de microcirculação. Para isso, é realizada terapia com heparina. 15. Laringoespasmo O laringoespasmo é o fechamento das cordas vocais verdadeiras e falsas. Em ambos os casos, são obrigatoriamente utilizados agentes de controle (eufilina). Se isso não ajudar, é necessário introduzir relaxantes musculares de curta duração, intubar e transferir o paciente para ventilação mecânica. Os relaxantes musculares causam insuficiência respiratória no pós-operatório se não for realizada descurarização suficiente. Geralmente é produzido por drogas anticolinesterásicas (prozerina). No momento da extubação, é necessário certificar-se de que a força e o tônus muscular foram recuperados (peça para levantar a mão, apertar a mão, levantar a cabeça). Com múltiplas fraturas das costelas, parte do tórax afunda durante a inspiração, a chamada respiração paradoxal se desenvolve, por isso é necessário restaurar a estrutura torácica. Para este paciente, é necessária a intubação, após a introdução de relaxantes, com posterior transferência para ventilação mecânica (até que a integridade do tórax seja restabelecida). O seguinte leva a uma diminuição do parênquima pulmonar funcionante: atelectasia, colapso pulmonar, pneumonia, consequências da cirurgia, pneumo-, hemo-, piotórax. Diferenças entre atelectasia e colapso: atelectasia é uma obstrução em estado de endireitamento. Esta condição é caracterizada pela presença de um pulmão não ventilado através do qual passa metade do sangue circulante, este último não é oxigenado. Como resultado, desenvolve-se insuficiência respiratória aguda. Quando o pulmão colapsa, é comprimido pelo ar ou fluido na cavidade pleural. Ao mesmo tempo, a circulação sanguínea no pulmão comprimido diminui drasticamente e a circulação sanguínea no pulmão saudável aumenta. Portanto, o colapso não é uma complicação tão perigosa em termos de desenvolvimento de insuficiência respiratória aguda quanto a atelectasia. Antes da cirurgia, a função do pulmão intacto deve ser avaliada (espirografia separada). De acordo com o estágio de desenvolvimento, a insuficiência respiratória aguda é dividida em: 1) disfunção; 2) insuficiência; 3) falha da função protética. De acordo com a taxa de desenvolvimento, a insuficiência respiratória aguda é dividida em: 1) rápido como um relâmpago (se desenvolve em um minuto); 2) aguda (desenvolve-se em poucas horas); 3) subagudo (se desenvolve em poucos dias); 4) crônica (dura anos). Os principais elementos da terapia intensiva para insuficiência respiratória aguda: oxigenoterapia, posição de drenagem do paciente, fibrobroncoscopia, traqueostomia, intubação e ventilação mecânica, broncodilatação, hormonioterapia, OHB. 16. Embolia pulmonar A embolia pulmonar (EP) é um bloqueio do tronco principal ou médio, pequenos troncos vasculares da artéria pulmonar, levando a um aumento da pressão na circulação pulmonar, insuficiência ventricular direita. Classificação clínica da EP Forma: pesado, médio e leve. A jusante: fulminante, agudo, recorrente. De acordo com o nível de dano da artéria pulmonar: tronco ou ramos principais, ramos lobares (segmentares), ramos pequenos. O curso clínico da EP é bastante variável. Os sintomas mais comuns são o início súbito de falta de ar (RR varia de 30 a mais de 50 por minuto), respiração rápida, palidez, mais frequentemente cianose, inchaço das veias jugulares, taquicardia, hipotensão arterial (até choque), retroesternal dor, tosse e hemoptise. A ausculta muitas vezes determina o fortalecimento do tônus II sobre a artéria pulmonar. Sinais de raios-X - aumento do tamanho da artéria pulmonar proximal, depleção do padrão periférico, bem como elevação da cúpula do diafragma. O ECG pode revelar sobrecarga dos departamentos direitos (cor pulmonale): 1) aparecimento de ondas Q com aumento simultâneo da amplitude dos dentes R e S (síndrome QS); 2) rotação do coração em torno do eixo longitudinal com o ventrículo direito para frente (deslocamento da zona de transição para as derivações torácicas esquerdas); 3) supradesnivelamento do segmento ST com onda negativa nas derivações III, aUR, V1-V3; 4) o aparecimento ou aumento do grau de bloqueio da perna direita do feixe de His; 5) dente P "pulmonar" pontiagudo com desvio de seu eixo elétrico para a direita; 6) taquicardia sinusal ou forma taquissistólica de fibrilação atrial. A ecocardiografia permite detectar cor pulmonale agudo, determinar a gravidade da hipertensão na circulação pulmonar, avaliar o estado estrutural e funcional do ventrículo direito, detectar tromboembolismo nas cavidades cardíacas e nas principais artérias pulmonares, visualizar um forame oval aberto, que pode afetar a gravidade dos distúrbios hemodinâmicos e ser a causa de embolia paradoxal. No entanto, um resultado ecocardiográfico negativo de forma alguma exclui o diagnóstico de embolia pulmonar. O método diagnóstico mais informativo é a angiografia da artéria pulmonar. tratamento 1. Terapia anticoagulante. 2. Terapia trombolítica. 3. Tratamento cirúrgico. 17. Tratamento de emergência do estado de mal asmático Oxigenoterapia. O oxigênio umedecido é inalado2através de cateteres nasais ou através de uma máscara a uma taxa de 1-2 l / min. A adrenalina estimula α1-,β., - e β2receptores adrenérgicos, dilata os brônquios e reduz a resistência das vias aéreas. A eufilina inibe a fosfodiesterase, o que contribui para o acúmulo de AMP cíclico e a remoção do broncoespasmo. Ao prescrever a aminofilina, deve-se levar em consideração as contraindicações, que incluem tabagismo e infância, insuficiência cardíaca e síndrome coronariana aguda, doenças crônicas dos pulmões, fígado e rins. Com EA, a dose de ataque de aminofilina é de 3-6 mg/kg, administrada por via intravenosa durante 20 minutos. Em seguida, realize a infusão por gotejamento de manutenção do medicamento. O efeito da terapia com corticosteroides está associado à supressão da inflamação das vias aéreas e aumento da sensibilidade aos agentes β-adrenérgicos. Quanto mais grave a EA, maior a indicação de corticoterapia imediata. Uma alta dose de corticosteróides deve ser administrada inicialmente. Se a terapia for ineficaz, a dose é aumentada. Pelo menos a cada 6 horas, doses equivalentes apropriadas desses medicamentos são administradas. A maioria dos pacientes recebe terapia de inalação com b - adrenomiméticos; (fenoterol, alupent, salbutamol). As exceções são os casos de overdose de simpaticomiméticos. Se a terapia em andamento não surtir efeito, está indicada a administração intravenosa de agonistas β-adrenérgicos, como o isoproterenol, diluído em solução de glicose a 5%. As contra-indicações são doenças cardíacas (cardiosclerose coronariana, infarto do miocárdio), taquicardia grave e sintomas de taquifilaxia, velhice. A taxa de administração de isoproterenol é de 0,1 μg/kg por 1 min até o início da taquicardia (HR 130 por 1 min ou mais). A terapia de infusão é o componente mais importante do tratamento da EA, visando repor a deficiência de fluidos e eliminar a hipovolemia, o volume total da terapia de infusão é de 3-5 litros por dia. A hidratação é realizada introduzindo soluções contendo uma quantidade suficiente de água livre (soluções de glicose), bem como soluções eletrolíticas hipo e isotônicas contendo sódio e cloro. Indicadores de hidratação adequada são a cessação da sede, língua molhada, restauração da diurese normal, melhor evacuação do escarro e diminuição do hematócrito para 0,30-0,40. A anestesia com halotano pode ser usada no tratamento de um ataque de asma grave que não é passível de terapia convencional. Ventilação artificial dos pulmões. As indicações para a transferência de pacientes com EA para ventilação mecânica devem ser muito rigorosas, pois nesse estado muitas vezes causa complicações e é caracterizada por alta mortalidade. Ao mesmo tempo, a ventilação mecânica, se realizada de acordo com indicações estritas, é o único método que pode impedir a progressão da hipóxia e da hipercapnia. 18. Infarto do miocárdio O infarto do miocárdio é uma discrepância entre a demanda miocárdica de oxigênio e sua oferta, resultando em necrose limitada do músculo cardíaco. A causa mais comum é um trombo, menos frequentemente um êmbolo, menos frequentemente um espasmo das artérias coronárias. A trombose é mais frequentemente observada no contexto de danos ateroscleróticos nas artérias coronárias. Classicamente, o infarto do miocárdio começa com o aumento da dor atrás do esterno, que está queimando e pressionando por natureza. Caracterizada por extensa irradiação de dor nos braços (geralmente à esquerda), costas, abdômen, cabeça, sob o ombro esquerdo, na mandíbula esquerda, etc. Os pacientes estão inquietos, ansiosos, às vezes notam uma sensação de medo de morte. Há sinais de insuficiência cardíaca e vascular - extremidades frias, suor úmido, etc. A síndrome da dor é prolongada e não é aliviada pela nitroglicerina por 30 minutos ou mais. Existem vários distúrbios do ritmo cardíaco, uma queda na pressão arterial ou seu aumento. Os pacientes observam subjetivamente a sensação de falta de ar. Os sinais acima são típicos do período I - doloroso ou isquêmico, cuja duração varia de várias horas a 2 dias. Objetivamente, um aumento da pressão arterial (depois uma diminuição); aumento da frequência cardíaca ou distúrbio do ritmo; na ausculta, ouve-se um tom IV anormal; os sons cardíacos são abafados; no tom de acento II da aorta; praticamente não há alterações bioquímicas no sangue, sinais característicos no ECG. O segundo período é agudo (febril, inflamatório), caracterizado pela ocorrência de necrose do músculo cardíaco no local da isquemia. A dor geralmente passa. A duração do período agudo é de até 2 semanas. O bem-estar do paciente melhora gradualmente, mas persistem fraqueza geral, mal-estar e taquicardia. Os sons cardíacos são abafados. O aumento da temperatura corporal causado pelo processo inflamatório no miocárdio, geralmente pequeno, até 38°C, costuma aparecer no 3º dia de doença. No final da primeira semana, a temperatura geralmente volta ao normal. A terceira menstruação (subaguda ou cicatrizante) dura de 4 a 6 semanas. Característica é a normalização dos parâmetros sanguíneos (enzimas), a temperatura do corpo normaliza, todos os outros sinais de um processo agudo desaparecem: o ECG muda, uma cicatriz de tecido conjuntivo se desenvolve no local da necrose. O quarto período (período de reabilitação, recuperação) dura de 6 meses a 1 ano. Não há sinais clínicos. Durante esse período, ocorre hipertrofia compensatória das fibras musculares miocárdicas intactas e outros mecanismos compensatórios se desenvolvem. Há uma restauração gradual da função miocárdica. Mas a onda Q patológica persiste no ECG. O tratamento visa a prevenção de complicações, limitação da zona de infarto, alívio da dor e correção da hipóxia. 19. Choque cardiogênico O choque cardiogênico é um distúrbio circulatório crítico com hipotensão arterial e sinais de deterioração aguda da circulação sanguínea em órgãos e tecidos. O principal sinal diagnóstico é uma diminuição significativa da pressão arterial sistólica, que está abaixo de 90 mm Hg. Arte. A diferença entre a pressão sistólica e diastólica (pressão de pulso) é de 20 mm Hg. Arte. ou ficando ainda menor. Além disso, está se desenvolvendo uma clínica de deterioração acentuada na perfusão de órgãos e tecidos: 1) consciência prejudicada de letargia leve a psicose ou coma, sintomas neurológicos focais podem aparecer; 2) diurese inferior a 20 ml/h. Sintomas de deterioração da circulação periférica: pálida cianótica, marmoreada, tijolo, pele úmida; veias periféricas colapsadas, uma diminuição acentuada da temperatura da pele das mãos e dos pés; diminuição do fluxo sanguíneo. O valor do CVP pode ser diferente. Os indicadores normais de PVC são 5-8 cm de água. Arte.; indicador abaixo de 5 cm de água. Arte. indica hipovolemia e pressão arterial baixa, e acima de 8 cm de água. Arte. indica insuficiência ventricular direita. tratamento A oxigenoterapia com oxigênio umidificado através de máscara ou cateteres nasais está indicada. Anticoagulantes administrados dolorosamente na dose de 10 UI, seguidos de infusomat intravenoso 000 UI por hora. É necessário administrar analgésicos: morfina 1000% 1 ml por via subcutânea ou intravenosa em bolus; analgin 1,0% 50 ml por via intramuscular, intravenosa. Tônicos vasculares: Cordiamin 1-4 ml por via intravenosa; mezaton 1% 1,0 g por via subcutânea, intravenosa, em solução salina; norepinefrina 0,2% 1,0 g por via intravenosa. O verdadeiro choque cardiogênico é tratado da seguinte forma. Para aumentar a atividade contrátil do miocárdio, o seguinte é usado: estrofantina 0,05% 0,5-0,75 g por via intravenosa lentamente por solução isotônica 20,0, korglukon 0,01 g por via intravenosa, também em solução isotônica ou mistura polarizadora, glucagon 2-4 mg por via intravenosa gotejamento em um solução polarizadora. Normalização da pressão arterial: norepinefrina 0,2% 2-4 ml por 1 litro de solução de glicose a 5% ou solução isotônica. A PA é mantida em 100 mm Hg. Art., mezaton 1% 1,0 g por via intravenosa; cordiamina 2-4 ml, dopamina 200 mg em 400 ml de reopoliglucina ou glicose a 5%. Com um efeito instável dos medicamentos acima, são usados 200 mg de hidrocortisona, 90-120 mg de prednisolona. Normalização das propriedades reológicas do sangue. Eliminação da hipovolemia, pois a parte líquida do sangue está suando: reopoliglicucina, poliglucina - em um volume de até 100 ml a uma taxa de 50,0 ml por minuto. Correção do equilíbrio ácido-base (combate à acidose): bicarbonato de sódio 5% a 200,0 ml. Reintrodução de analgésicos. Restauração de distúrbios de ritmo e condução. 20. Crise hipertensiva Uma crise hipertensiva é um aumento súbito da pressão arterial a um nível que geralmente não é característico desse paciente, levando a distúrbios circulatórios regionais agudos e danos a órgãos-alvo (coração, cérebro, rins, intestinos). Os fatores externos que provocam uma crise podem ser: 1) estresse psicoemocional; 2) influências meteorológicas; 3) consumo excessivo de sal de mesa. Os sintomas clínicos de uma crise são manifestados por ruído nos ouvidos, moscas piscando diante dos olhos, dor de cabeça explosiva na região occipital, agravada pela inclinação, esforço, tosse, náusea, vômito, distúrbios do ritmo cardíaco. Durante uma crise, ocorrem violações perigosas da circulação coronária cerebral, menos frequentemente renal e abdominal, o que leva a acidente vascular cerebral, infarto do miocárdio e outras complicações graves. O ECG revela hipertrofia ventricular esquerda. A radiografia de tórax mostra um coração aumentado, deformidade aórtica na forma do número "3", usura das costelas como resultado do aumento do fluxo sanguíneo colateral através das artérias intercostais. A aortografia confirma o diagnóstico. A forma neurovegetativa da crise é caracterizada por início súbito, excitação, hiperemia e umidade da pele, taquicardia, micção abundante frequente, aumento predominante da pressão sistólica com aumento da amplitude de pulso. Essas crises também são chamadas de crises adrenais ou tipo I. As crises do tipo I geralmente têm um curso relativamente benigno, embora possam levar a arritmias paroxísticas ou angina de peito e, em casos graves, infarto do miocárdio. Com a forma de água salgada da crise, a condição piora gradualmente, sonolência, fraqueza, letargia, desorientação, palidez e inchaço do rosto e inchaço são observados. As pressões sistólica e diastólica aumentam uniformemente ou com predomínio desta última e diminuição da pressão de pulso. Tais crises são chamadas de crises do tipo II. As crises do tipo II, como regra, são graves e podem ser complicadas por infarto do miocárdio, acidente vascular cerebral, insuficiência ventricular esquerda aguda. É necessário destacar as crises hipertensivas que se desenvolvem em decorrência da interrupção abrupta da terapia anti-hipertensiva permanente, em particular, do uso de betabloqueadores, nifedipina, simpaticolíticos e, principalmente, clonidina. O tratamento de uma crise hipertensiva consiste em uma diminuição urgente da pressão arterial para um nível normal, necessária para prevenir ou limitar danos a órgãos-alvo na hipertensão, para prevenir complicações até a morte nos casos mais graves, ou incapacidade permanente no desenvolvimento de acidente vascular cerebral , infarto do miocárdio. 21. Arritmia. Paroxismo da fibrilação atrial Uma arritmia é um ritmo cardíaco diferente do sinusal. Classificação das arritmias 1. Violação da formação de impulsos: 1) no nó sinusal: a) taquicardia sinusal; b) bradicardia sinusal; c) arritmia sinusal; d) síndrome do nódulo sinusal (SSS); 2) arritmias ectópicas: a) extra-sístole; b) taquicardia paroxística; c) fibrilação e flutter atrial; d) cintilação e vibração dos ventrículos. 2. Violação de condução de impulso: 1) vias adicionais (pacotes Kent); 2) bloqueio cardíaco: a) atrial (intra-atrial); b) atrioventricular; c) intraventricular. Mecanismos de arritmias Uma diminuição no potencial de repouso, o limiar de excitabilidade ocorre apenas com base em uma deficiência de potássio celular, a proporção "plasma - célula" (normalmente 80 meq de potássio está na célula e 5 meq no plasma). Assimetria do foco eletrofisiológico-metabólico do miocárdio devido à isquemia, inflamação, reperfusão durante a trombólise. Fraqueza eletrofisiológica do marcapasso superior. Vias de condução acessórias congênitas. A taquicardia supraventricular paroxística é um ataque súbito de batimentos cardíacos com uma frequência de 150-250 batimentos por minuto. Existem 3 formas: 1) atrial; 2) nodal; 3) ventricular. A etiologia da taquicardia paroxística supraventricular está mais frequentemente associada a um aumento da atividade do sistema nervoso simpático. Manifesta-se clinicamente por um ataque súbito do batimento cardíaco, os vasos do pescoço pulsam, a atividade cardíaca muda para um ritmo diferente. A duração do ataque é de vários minutos a vários dias. O número de batimentos cardíacos na forma ventricular geralmente está na faixa de 150-180 batimentos por minuto, com formas supraventriculares - 180-240 batimentos por minuto. Durante um ataque, um ritmo tipo pêndulo é auscultatório característico, não há diferença entre o tom I e II. Aumenta a demanda miocárdica de oxigênio e pode provocar um ataque de insuficiência coronariana aguda. Sinais de ECG 1. Os complexos QRS não são alterados. 2. Na forma supraventricular, a onda P se funde com a T. 22. Extrassístole ventricular. Distúrbio de condução AV A extra-sístole ventricular é a ocorrência de um complexo QRS extraordinariamente largo e deformado, deslocamento discordante de ST e T, uma pausa compensatória completa (o intervalo entre a onda P pré e pós-extra-sistólica é igual a duas vezes o intervalo RR normal). A droga de escolha é a lidocaína, que é administrada de acordo com o esquema acima. Talvez o uso de cordarone na dose de 300-450 mg por gotejamento intravenoso. Violação da condução AV com desenvolvimento de síncope (síndrome de Morgagni-Adams-Stokes) Quando a condução é perturbada, ocorrem vários tipos de bloqueios cardíacos, há uma desaceleração ou cessação completa da condução do impulso através do sistema de condução do coração. O bloqueio sinoauricular é caracterizado por disfunção das células T e condução prejudicada de impulsos do nó sinusal para os átrios. Existem 3 graus. Eu grau - desacelerando o impulso. No ECG - prolongamento do intervalo PQ por mais de 0,20 s. Prolapso do complexo QRS. O intervalo RR é estável. II grau - perda de parte dos impulsos, condução incompleta. Mobitz tipo I - à medida que os impulsos são executados, o intervalo PQ aumenta gradualmente até a perda completa da onda de pulso. QRS não é alterado. No local do prolapso do QRS, a maior distância é RR. Prognosticamente, este tipo é relativamente favorável. Mobitz tipo II com intervalo PQ constante e complexo QRS inalterado. Ao mesmo tempo, nem todos os impulsos atingem os ventrículos - em alguns casos, cada segundo impulso é realizado, em outros - a cada terço, etc., ou seja, há um prolapso periódico do complexo QRS 3: 2, 4: 3 , 5: 6, etc. d. III grau - bloqueio completo da condução. Ao mesmo tempo, a condução de impulsos para os ventrículos pára completamente, nos ventrículos nasce seu próprio foco heterotópico de ritmo idioventricular, e quanto menor o automatismo, mais difícil a clínica. A dissociação completa é observada: o ritmo atrial está próximo do normal e os ventrículos têm sua própria frequência - 40 batimentos por minuto ou menos. Este último depende do nível de dano: se o nó AV sofre, 40-50 batimentos por 1 minuto, se a perna do feixe de His - 20 batimentos por 1 minuto ou menos. O nível de dano também é indicado pelo grau de deformação do complexo QRS. Os sons cardíacos são enfraquecidos, periodicamente há um tom de "canhão" I, quando a sístole dos átrios e ventrículos quase coincidem no tempo. Pode ser III tom adicional. Sopros de ejeção sistólicos podem aparecer na base do coração. Freqüentemente, uma pulsação das veias associada à contração atrial é encontrada, especialmente distinta com o tom de canhão de Strazhesko. Clínica Falha do coração, se um impulso cair. Vertigem se vários impulsos caem. Síndrome de Morgagni-Adams-Stokes (perda de consciência), se 6-8 complexos caem. tratamento Para restaurar um ritmo adequado, administra-se atropina na dose de 0,5-1 mg a 3 mg. A cada 3 minutos, 1 mg até uma dose total de 0,4 mg/kg. Antagonistas do cálcio - isoptina 0,04 mg/kg. Com perda frequente de consciência, o paciente é transferido para terapia de eletropulso permanente. Mas, com mais frequência, a estimulação deve ser feita "sob demanda". 23. Causas de insuficiência renal aguda A insuficiência renal aguda (IRA) é uma complicação de uma série de doenças renais e extrarrenais caracterizada por uma acentuada deterioração ou cessação da função renal e manifestada pelo seguinte complexo de sintomas: oligoanúria, azotemia, hiperidratação, CBS prejudicado e equilíbrio hídrico e eletrolítico. As formas de POO incluem: 1) pré-renal (hemodinâmica); 2) renal (parenquimatoso); 3) pós-renal (obstrutivo); 4) areal. Razões para o desenvolvimento de insuficiência renal aguda pré-renal. 1. Débito cardíaco diminuído (choque cardiogênico, arritmia paroxística, tamponamento cardíaco, embolia pulmonar, insuficiência cardíaca congestiva). 2. Redução do tônus vascular (sepse, choque tóxico-infeccioso, choque anafilático, overdose de anti-hipertensivos). 3. Diminuição do volume intravascular efetivo (perda de sangue, perda de plasma, desidratação - perda de 7-10% do peso corporal). 4. Violação da hemodinâmica intrarrenal (uso de AINEs, inibidores da ECA, drogas radiopacas, sandimune). 5. Intoxicação por água - hiperhidratação (produção descontrolada de ADH em tumores malignos, doenças inflamatórias do sistema nervoso central, overdose de drogas - drogas, barbitúricos, drogas antidiabéticas sulfanilamida, indometacina, amitriptilina, ciclofosfamida). Razões para o desenvolvimento de insuficiência renal aguda renal. 1. Isquemia do rim. 2. Danos nefrotóxicos devido à exposição a: 1) fármacos (aminoglicosídeos, AINEs, fármacos radiopacos, etc.; 2) nefrotoxinas industriais (sais de metais pesados); 3) nefrotoxinas domésticas (etilenoglicol, álcool metílico, dicloroetano, tetracloreto de carbono). 3. Obstrução intratubular por pigmentos: 1) hemoglobina; 2) uratos; 3) mioglobina; 4) processos inflamatórios; 5) papilite necrótica (diabetes mellitus, analgésico, nefropatia alcoólica); 6) patologia vascular. Razões para o desenvolvimento de insuficiência renal aguda pós-renal. 1. Patologia dos ureteres: 1) obstrução; 2) compressão. 2. Patologia da bexiga. 3. Estenose uretral. 24. Clínica e tratamento da insuficiência renal aguda Existem cinco estágios no curso clínico da insuficiência renal aguda. O estágio I da insuficiência renal aguda é inicial, dura desde o momento em que ocorre o fator etiológico até o aparecimento dos primeiros sinais. Nesta fase, as táticas terapêuticas visam eliminar ou mitigar o impacto do fator etiológico: terapia antichoque, reposição do CBC, combate à insuficiência cardíaca, terapia alcalinizante para hemólise intravascular, combate à dor, tratamento de quadros sépticos, etc. terapia, o espasmo dos vasos renais é eliminado sob o controle da diurese horária. Quanto mais cedo for iniciada a estimulação da diurese, mais favorável será o prognóstico. O estágio II da insuficiência renal aguda, ou oligoanúrico, é caracterizado pela disfunção de 70% dos néfrons. A produção de urina inferior a 500 ml por dia indica o desenvolvimento de oligúria, e uma diminuição para 50 ml por dia ou menos indica anúria. Junto com a capacidade prejudicada de excreção de água dos rins, as funções de concentração e excreção de nitrogênio também sofrem. A quantidade de eletrólitos e nitrogênio na urina diminui drasticamente. Nesta fase ocorrem as alterações mais pronunciadas na hemostasia. O tratamento deve visar a constância do ambiente interno, a fim de permitir tempo e oportunidade para a regeneração do epitélio renal. Um estado de hiperidratação se desenvolve devido à perda de eletrólitos durante o vômito e a diarreia. Portanto, é necessário estimular a diurese, mas apenas sob o controle da PVC. Melhorar o fluxo sanguíneo renal. Como é necessário realizar um controle rigoroso da diurese, o cateterismo vesical é realizado. A violação da função de excreção de nitrogênio dos rins leva à azotemia, portanto, para maximizar a prevenção da quebra de proteínas no corpo, é necessário introduzir uma quantidade suficiente de carboidratos. Se o curso for grave e não tratável, as sessões de hemodiálise são realizadas. Se o fator etiológico for removido, após 5-7 dias de tratamento, a diurese começa a aumentar. A duração máxima desta fase é de até 2 semanas. III etapa de insuficiência renal aguda - poliúrico precoce. Caracteriza-se por um aumento progressivo da diurese (em 200-300 ml por dia) até 3 litros. As funções de excreção e concentração de nitrogênio dos rins ainda não foram totalmente recuperadas, mas a concentração de potássio, magnésio e fosfatos está gradualmente se normalizando. A terapia intensiva na fase poliúrica inicial deve incluir as mesmas medidas da anterior, exceto pela estimulação da diurese. Muitas vezes, a hemodiálise é necessária. Há um alto risco de desidratação. IV estágio de insuficiência renal aguda - poliúria tardia. O aumento diário da urina atinge 500-1000 ml, e a diurese pode chegar a 8-10 litros por dia ou mais. Nos rins, os processos de troca iônica começam a se recuperar. As perdas de potássio, magnésio, fósforo e outros eletrólitos aumentam acentuadamente, os pacientes correm o risco de desidratação e desmineralização. Portanto, eletrólitos e fluidos são administrados por via intravenosa nesta fase. Estágio V OPN, ou estágio de recuperação. A função de concentração dos rins é restaurada. A diurese começa a diminuir gradualmente ao normal (2-3 litros por dia) e a densidade da urina aumenta (1008-1028). 25. Insuficiência hepática aguda A insuficiência hepática aguda é um complexo de sintomas caracterizado por uma violação de uma ou mais funções hepáticas devido a danos agudos ou crônicos em seu parênquima. As manifestações clínicas da IRA são as seguintes. 1. A coagulopatia é causada por deficiência dos fatores de coagulação e aumento da atividade fibrinolítica. Predispõe ao sangramento espontâneo das membranas mucosas: sangramento gastrointestinal, uterino, nasal pode ser observado. Hemorragias cerebrais são possíveis. Para avaliar o estado do sistema de hemostasia, o tempo de protrombina é determinado. 2. A hipoglicemia é caracterizada por um alto nível de insulina no plasma, que se deve à diminuição de sua captação pelo fígado. Isso leva a uma rápida deterioração do estado neurológico e morte dos pacientes. 3. Violações do equilíbrio hidroeletrolítico e ácido-base. A insuficiência renal aguda em estágio final é caracterizada por hiponatremia, hipofosfatemia, hipocalcemia e hipomagnesemia. A mudança no estado ácido-base não tem uma direção inequívoca. A alcalose respiratória associada à estimulação do centro respiratório com substâncias tóxicas pode ser substituída por acidose respiratória devido ao aumento da pressão intracraniana e supressão da atividade respiratória. No desenvolvimento do coma hepático como um curso grave da doença, distinguem-se os estágios de pré-coma, coma ameaçador e coma propriamente dito. Há também coma hepatocelular (endógeno) decorrente de necrose maciça do parênquima, porto-cava (bypass, shunt, exógeno), devido a uma exclusão significativa do fígado dos processos metabólicos devido à presença de anastomoses porto-cava pronunciadas, e coma misto, ocorrendo principalmente na cirrose hepática. No período pré-comatoso, desenvolve-se anorexia progressiva, náusea, diminuição do tamanho do fígado, aumento da icterícia, hiperbilirrubinemia e aumento do conteúdo de ácidos biliares no sangue. No futuro, aumentam os distúrbios neuropsíquicos, a lentidão do pensamento, a depressão e, às vezes, a euforia. Caracterizado por instabilidade de humor, irritabilidade, a memória é perturbada, o sono é perturbado. Os reflexos tendinosos estão aumentados, um pequeno tremor dos membros é característico. A azotemia se desenvolve. Com terapia oportuna, os pacientes podem sair desse estado, mas com mais frequência com graves alterações irreversíveis no fígado, ocorre coma. Durante o período de coma, é possível a excitação, que é então substituída por depressão (estupor) e um comprometimento progressivo da consciência até sua perda completa. Fenômenos meníngeos, reflexos patológicos, inquietação motora, convulsões se desenvolvem. A respiração é perturbada (como Kussmaul, Cheyne-Stokes); o pulso é pequeno, arrítmico; há hipotermia. O rosto do paciente está abatido, as extremidades estão frias, um odor adocicado hepático característico emana da boca e da pele, os fenômenos hemorrágicos se intensificam (hemorragias cutâneas, sangramento do nariz, gengivas, varizes do esôfago, etc.). 26. Tratamento da insuficiência hepática aguda O suporte inotrópico oportuno é um componente essencial da terapia intensiva. Prevenção de complicações infecciosas - a nomeação de antibióticos cefalosporínicos em combinação com medicamentos antifúngicos (anfotericina-B). Hepatoprotetores e estabilizadores de membrana: prednisolona até 300 mg, vitamina C 500 mg, troxevasina 5 ml, etamsilato de sódio 750 mg, Essentiale 30 ml, tocoferol 4 ml por via intramuscular, cytomak 35 mg, cocarboxilase 300 mg, ácido nicotínico 30-40 mg, com-plamin 900 mg, sirepar 5-10 ml, ácido glutâmico 1% 400 ml, vikasol 10 ml por via intravenosa, vitaminas B. Inibidores de protease, que incluem cortri-cal 100 mil unidades, trasilol 400 mil unidades, antagonosan, go-dox. Estimulação da diurese: reogluman 400 ml, manitol, lasix até 200 mg por via intravenosa, eufilin 240 mg. Para corrigir a coagulopatia, é utilizada a administração intravenosa de vitamina K (10 mg por dia durante 3 dias). O efeito ocorre após 3 horas, neste caso, a eliminação da hipoprotrombinemia associada à absorção prejudicada da vitamina K, decorrente da deficiência de ácidos biliares. Em caso de sangramento ou suspeita de procedimentos invasivos (cateterismo vascular, diálise peritoneal), a massa plaquetária ou plasma fresco congelado é administrado por via intravenosa. O edema cerebral é uma causa comum de morte. O manitol é administrado na proporção de 1 g/kg de peso corporal. Em pacientes com insuficiência renal, o manitol é prescrito em combinação com ultrafiltração para evitar hiperosmolaridade e superhidratação. Com o desenvolvimento de coma hepático, é prescrito cloreto de potássio (solução de 0,4-0,5% em solução de glicose a 5% com volume de 500 ml por via intravenosa) ou solução de bicarbonato de sódio (com acidose metabólica); Os pacientes respiram oxigênio umidificado através de um cateter nasal. Com uma diminuição da pressão arterial e venosa, a poliglucina e a albumina são administradas por via intravenosa. Na presença de sangramento maciço, as medidas apropriadas são tomadas para pará-lo, o sangue de um grupo é transfundido e os medicamentos que contêm fatores de coagulação do sangue são administrados. Com sinais significativos de coagulação intravascular disseminada, a heparina é administrada por via intravenosa na dose de 10-000 UI em bolus. Em caso de insuficiência renal, são realizadas hemodiálise peritoneal e plasmaférese, que dão um bom resultado, mas antes de realizar essas manipulações, a introdução de heparina é contraindicada. Para parar a agitação psicomotora e convulsões, são prescritos diprazina, haloperidol, oxibutirato de sódio. Em casos graves, recorrer à intubação e ventilação mecânica. É importante lembrar que há um alto risco de sangramento, portanto, todas as manipulações devem ser realizadas com extrema cautela. Ao retirar o paciente do coma, o próximo passo é realizar terapia intensiva para a doença subjacente. 27. Choque O choque é uma forma de estado crítico do corpo, manifestado por disfunção de múltiplos órgãos, desenvolvendo-se em cascata com base em uma crise generalizada de circulação e, via de regra, terminando em morte sem tratamento. Um fator de choque é qualquer efeito no corpo que exceda os mecanismos adaptativos em força. No choque, as funções da respiração, do sistema cardiovascular e dos rins mudam, os processos de microcirculação de órgãos e tecidos e os processos metabólicos são interrompidos. O choque é uma doença de natureza polietiológica. Dependendo da etiologia da ocorrência, os tipos de choque podem ser diferentes. 1. Choque traumático: 1) com lesões mecânicas - fraturas ósseas, feridas, compressão de tecidos moles, etc.; 2) com queimaduras (queimaduras térmicas e químicas); 3) sob a influência de baixa temperatura - choque frio; 4) em caso de lesões elétricas - choque elétrico. 2. Choque hemorrágico ou hipovolêmico: 1) desenvolve-se como resultado de sangramento, perda aguda de sangue; 2) como resultado de uma violação aguda do equilíbrio hídrico, ocorre a desidratação do corpo. 3. Choque séptico (tóxico para bactérias) (processos purulentos generalizados causados por microflora gram-negativa ou gram-positiva). 4. Choque anafilático. 5. Choque cardiogênico (infarto do miocárdio, insuficiência cardíaca aguda). Considerado na seção condições de emergência em cardiologia. Em todos os tipos de choque, o principal mecanismo de desenvolvimento é a vasodilatação e, como resultado, a capacidade do leito vascular aumenta, hipovolemia - o volume de sangue circulante (CBC) diminui, pois existem vários fatores: perda de sangue, redistribuição de fluido entre o sangue e os tecidos, ou uma incompatibilidade do volume normal de sangue aumentando a capacidade vascular. A discrepância resultante entre o CBC e a capacidade do leito vascular está subjacente à diminuição do débito cardíaco e aos distúrbios da microcirculação. Este último leva a sérias mudanças no corpo, pois é aqui que a principal função da circulação sanguínea é realizada - a troca de substâncias e oxigênio entre a célula e o sangue. Ocorre espessamento do sangue, aumento de sua viscosidade e microtrombose intracapilar. Subsequentemente, as funções das células são interrompidas até a sua morte. Nos tecidos, os processos anaeróbios começam a predominar sobre os aeróbicos, o que leva ao desenvolvimento de acidose metabólica. O acúmulo de produtos metabólicos, principalmente ácido lático, aumenta a acidose. 28. Choque anafilático O choque anafilático é um complexo de várias reações alérgicas de tipo imediato, atingindo um grau extremo de gravidade. Existem as seguintes formas de choque anafilático: 1) forma cardiovascular, na qual se desenvolve insuficiência circulatória aguda, manifestada por taquicardia, muitas vezes com distúrbios do ritmo cardíaco, fibrilação ventricular e atrial e diminuição da pressão arterial; 2) forma respiratória, acompanhada de insuficiência respiratória aguda: falta de ar, cianose, estridor, respiração borbulhante, estertores úmidos nos pulmões. Isso se deve a uma violação da circulação capilar, inchaço do tecido pulmonar, laringe, epiglote; 3) forma cerebral por hipóxia, microcirculação prejudicada e edema cerebral. De acordo com a gravidade do curso, distinguem-se 4 graus de choque anafilático. O grau I (leve) é caracterizado por coceira na pele, aparecimento de erupções cutâneas, dor de cabeça, tontura, sensação de rubor na cabeça. Grau II (moderado) - Edema de Quincke, taquicardia, diminuição da pressão arterial, aumento do índice de Algover juntam-se aos sintomas previamente indicados. O grau III (grave) se manifesta por perda de consciência, insuficiência respiratória e cardiovascular aguda (falta de ar, cianose, respiração estridor, pulso pequeno e rápido, queda acentuada da pressão arterial, alto índice de Algover). O grau IV (extremamente grave) é acompanhado por perda de consciência, insuficiência cardiovascular grave: o pulso não é determinado, a pressão arterial é baixa. Tratamento 1. Infusão intravenosa de adrenalina até estabilização hemodinâmica. Você pode usar dopmin 10-15 mcg / kg / min, e com sintomas de broncoespasmo e b - adrenomiméticos: alupent, gotejamento brikanil por via intravenosa. 2. Terapia de infusão em um volume de 2500-3000 ml com a inclusão de poliglucina e reopoliglucina, a menos que a reação seja causada por esses medicamentos. Bicarbonato de sódio 4% 400 ml, soluções de glicose para restabelecer o CBC e hemodinâmica. 3. Estabilizadores de membrana por via intravenosa: prednisolona até 600 mg, ácido ascórbico 500 mg, troxevasina 5 ml, etamsilato de sódio 750 mg, citocromo C 30 mg (são indicadas doses diárias). 4. Broncodilatadores: eufilina 240-480 mg, noshpa 2 ml, alupent (brikanil) 0,5 mg gota a gota. 5. Anti-histamínicos: difenidramina 40 mg (suprastin 60 mg, tavegil 6 ml), cimetidina 200-400 mg por via intravenosa (são indicadas doses diárias). 6. Inibidores de protease: trasilol 400 mil U, contrais 100 mil U. 29. Choque traumático O choque traumático é uma condição patológica e crítica do corpo que surgiu em resposta a uma lesão, na qual as funções dos sistemas e órgãos vitais são prejudicadas e inibidas. Durante o choque do trauma, as fases torpe e erétil são distinguidas. No momento da ocorrência, o choque pode ser primário (1-2 horas) e secundário (mais de 2 horas após a lesão). Estágio erétil ou fase de ocorrência. Permanece a consciência, o paciente está pálido, inquieto, eufórico, inadequado, pode gritar, correr para algum lugar, desmaiar, etc. Nesta fase, a adrenalina é liberada, devido à qual a pressão e o pulso podem permanecer normais por algum tempo. A duração desta fase é de vários minutos e horas a vários dias. Mas na maioria dos casos é curto. A fase entorpecida substitui a erétil, quando o paciente se torna letárgico e adinâmico, a pressão arterial diminui e aparece a taquicardia. As estimativas da gravidade da lesão são fornecidas na tabela. Avaliação da extensão da gravidade da lesão
Após o cálculo dos pontos, o número resultante é multiplicado por um coeficiente (de 1,2 a 2,0). Tratamento. As principais direções no tratamento. 1. Eliminação da ação do agente traumático. 2. Eliminação da hipovolemia. 3. Eliminação da hipóxia. 30. Choque hemorrágico O choque hemorrágico é uma condição de insuficiência cardiovascular aguda que se desenvolve após uma perda significativa de sangue e leva a uma diminuição da perfusão de órgãos vitais. Etiologia: lesões com lesão de grandes vasos, úlceras gástricas e duodenais agudas, ruptura de aneurisma da aorta, pancreatite hemorrágica, ruptura do baço ou fígado, ruptura da tuba ou gravidez ectópica, presença de lóbulos placentários no útero, etc. De acordo com os dados clínicos e a magnitude da deficiência de volume sanguíneo, os seguintes graus de gravidade são distinguidos. 1. Não expresso - não há dados clínicos, o nível de pressão arterial é normal. O volume de perda de sangue é de até 10% (500 ml). 2. Fraco - taquicardia mínima, ligeira diminuição da pressão arterial, alguns sinais de vasoconstrição periférica (mãos e pés frios). O volume de perda de sangue é de 15 a 25% (750-1200 ml). 3. Moderado - taquicardia até 100-120 batimentos por minuto, diminuição da pressão de pulso, pressão sistólica 1-90 mm Hg. Art., ansiedade, sudorese, palidez, oligúria. O volume de perda de sangue é de 100 a 25% (35-1250 ml). 4. Grave - taquicardia superior a 120 batimentos por minuto, pressão sistólica abaixo de 60 mm Hg. Art., muitas vezes não determinado pelo tonômetro, estupor, palidez extrema, extremidades frias, anúria. O volume de perda de sangue é superior a 35% (mais de 1750 ml). Laboratório na análise geral do sangue, uma diminuição do nível de hemoglobina, eritrócitos e hematócrito. O ECG mostra alterações inespecíficas do segmento ST e da onda T, decorrentes de circulação coronariana insuficiente. O tratamento do choque hemorrágico inclui a interrupção do sangramento, o uso de terapia de infusão para restaurar o CBC, o uso de vasoconstritores ou vasodilatadores, dependendo da situação. A terapia de infusão envolve a administração intravenosa de fluido e eletrólitos em um volume de 4 litros (solução salina, glicose, albumina, poliglucina). Em caso de sangramento, a transfusão de sangue e plasma de grupo único é indicada em um volume total de pelo menos 4 doses (1 dose é de 250 ml). A introdução de drogas hormonais, como estabilizadores de membrana (prednisolona 90-120 mg), é mostrada. Dependendo da etiologia, é realizada terapia específica. 31. Choque séptico O choque séptico é a penetração de um agente infeccioso de sua fonte original no sistema sanguíneo e sua disseminação por todo o corpo. Os patógenos podem ser: bactérias estafilocócicas, estreptocócicas, pneumocócicas, meningocócicas e enterocócicas, bem como Escherichia, Salmonella e Pseudomonas aeruginosa, etc. O choque séptico é acompanhado por disfunção dos sistemas pulmonar, hepático e renal, violação do sistema de coagulação sanguínea, o que leva à ocorrência da síndrome trombohemorrágica (síndrome de Machabeli), que se desenvolve em todos os casos de sepse. O curso da sepse é influenciado pelo tipo de patógeno, o que é especialmente importante com métodos modernos de tratamento. Os achados laboratoriais indicam anemia progressiva (devido à hemólise e inibição da hematopoiese). Leucocitose até 12 χ 109/l, no entanto, em casos graves, à medida que se forma uma depressão acentuada dos órgãos hematopoiéticos, a leucopenia também pode ser observada. Sintomas clínicos de choque bacteriano: calafrios, febre alta, hipotensão, pele seca e quente - no início e depois - fria e úmida, palidez, cianose, distúrbio do estado mental, vômitos, diarréia, oligúria. Caracterizada por neutrofilia com desvio da fórmula leucocitária para a esquerda até os mielócitos; A ESR aumenta para 30-60 mm/h ou mais. O nível de bilirrubina no sangue é aumentado (até 35-85 µmol/l), o que também se aplica ao conteúdo de nitrogênio residual no sangue. A coagulação do sangue e o índice de protrombina são reduzidos (até 50-70%), o conteúdo de cálcio e cloretos é reduzido. A proteína total do sangue é reduzida, o que ocorre devido às albuminas, e o nível de globulinas (alfa globulinas e β - globulinas) aumenta. Na urina, proteína, leucócitos, eritrócitos e cilindros. O nível de cloretos na urina é reduzido e a uréia e o ácido úrico são elevados. O tratamento é principalmente de natureza etiológica, portanto, antes de prescrever a terapia antibacteriana, é necessário determinar o patógeno e sua sensibilidade aos antibióticos. Os agentes antimicrobianos devem ser utilizados em doses máximas. Para tratar o choque séptico, é necessário o uso de antibióticos que cubram todo o espectro de microrganismos gram-negativos. O mais racional é a combinação de ceftazidima e impinem, que se mostraram eficazes contra Pseudomonas aeruginosa. Medicamentos como clindamicina, metronidazol, ticarcilina ou imipinem são usados como medicamentos de escolha quando ocorre um patógeno resistente. Se os estafilococos forem cultivados no sangue, é imperativo iniciar o tratamento com penicilinas. O tratamento da hipotensão consiste na primeira etapa do tratamento na adequação do volume de líquido intravascular. Utilizar soluções cristalóides (solução isotônica de cloreto de sódio, Ringerlactato) ou colóides (albumina, dextrana, polivinilpirrolidona). A vantagem dos colóides é que quando são introduzidos, as pressões de enchimento necessárias são alcançadas mais rapidamente e permanecem assim por um longo tempo. Se não houver efeito, utiliza-se suporte inotrópico e (ou) drogas vasoativas. 32. Intoxicação por álcool metílico O álcool metílico é absorvido por todas as vias - respiratória, digestiva e transdérmica. A dose letal de metanol quando tomado por via oral varia de 40 a 250 ml, mas mesmo tomar 10 a 20 ml pode causar cegueira. A intoxicação também ocorre após a ingestão de várias misturas alcoólicas contendo de 1,5 a 2,5% de metanol. Uma vez absorvido, o metanol é distribuído por todos os tecidos devido à sua solubilidade em água. A maior quantidade acumula-se nos rins e no trato gastrointestinal, a menor no cérebro, músculos e tecido adiposo. As lesões patológicas incluem edema cerebral e danos à natureza inicialmente inflamatória e, posteriormente, distrófica das células ganglionares da retina. Em alguns casos, além de danos ao sistema nervoso, são encontradas lesões degenerativas do fígado, rins, pulmões e músculo cardíaco. No efeito tóxico do metanol, a ação bifásica pode ser distinguida. No período inicial (fase I), o metanol atua no corpo como uma molécula inteira e tem um efeito predominantemente narcótico, porém mais fraco que o álcool etílico. Posteriormente (fase II), manifesta-se o efeito nocivo dos produtos de oxidação. No quadro clínico, distinguem-se os períodos: intoxicação, latente ou bem-estar relativo (com duração de várias horas a 1-2 dias), as principais manifestações da intoxicação e, com um resultado favorável, o desenvolvimento reverso. De acordo com a gravidade, distinguem-se leves, moderados (ou oftálmicos) e graves (ou generalizados). Com envenenamento leve, observa-se fadiga, dor de cabeça, náusea e um estado de intoxicação leve, que ocorre após um período latente de 30 minutos a várias horas. A absorção simultânea de álcool etílico e metílico aumenta o período de latência e reduz a gravidade do envenenamento. Tratamento 1. Interromper a entrada de veneno no corpo. Cessação do uso de veneno, remoção da atmosfera contaminada, remoção de veneno da pele. 2. Remoção de veneno não absorvido (do trato gastrointestinal): 1) sondar a lavagem gástrica; 2) uso de adsorventes ou laxantes salinos; 3) limpeza ou enema de sifão. 3. Removendo o veneno absorvido: 1) forçar a diurese; 2) métodos de desintoxicação extracorpórea (hemossorção, hemodiálise, diálise peritoneal, cirurgia de reposição sanguínea). 4. Terapia de antídotos, ou seja, neutralização do veneno por neutralização física ou química, bem como competição com o veneno por pontos de aplicação. 5. Manter as funções vitais do corpo. 6. Normalização do estado hidroeletrolítico e ácido-base do corpo. 7. Tratamento das consequências e complicações a longo prazo. 33. Intoxicação por álcool etílico e etilenoglicol Ao tomar doses tóxicas - agitação, ataxia, estupor, coma com inibição de reflexos, cheiro de álcool da boca, rubor facial, conjuntivite, "jogo" das pupilas, vômitos, micção involuntária, taquicardia, respiração "rouca" , colapso, vômitos com possível aspiração de peso emético. tratamento Lavagem gástrica através de sonda grossa, seguida de introdução de laxante salino, enema sifão. Por via subcutânea 1 ml de uma solução de atropina a 0,1%, 2 ml de cordiamina, 1 ml de uma solução de cafeína a 20%, com colapso - por via intramuscular 1 ml de uma solução de mezaton a 1%. Na ausência de reflexos faríngeos - intubação traqueal e ventilação mecânica. Forçar a diurese com a administração simultânea de solução de bicarbonato de sódio a 4% em volume calculado pela fórmula de Astrup, soluções hipertônicas de glicose (10 e 20%) com insulina, vitaminas B e C, cocarboxilase, ácido nicotínico. Com depressão respiratória - lentamente por via intravenosa 3-5 ml de uma solução de etimizol a 1,5%, 10 ml de uma solução de aminofilina a 2,4%, 1 ml de uma solução de efedrina a 5%, inalação de oxigênio. Com aspiração - broncoscopia de saneamento de emergência. Antibióticos parenterais. Intoxicação por etilenoglicol (anticongelante) A dose letal média é de aproximadamente 100 ml. É rapidamente absorvido no trato digestivo e distribuído para todos os tecidos, criando uma concentração máxima no cérebro. O principal efeito tóxico é observado no parênquima renal, onde se desenvolvem necrose do epitélio tubular, edema intersticial e focos de necrose hemorrágica na camada cortical. O edema é encontrado no cérebro. Na clínica de intoxicação, distinguem-se 3 períodos: 1) inicial - com duração de até 12 horas, predominam sintomas de lesão do SNC pelo tipo de intoxicação alcoólica; 2) neurotóxico - quando os sintomas de lesão do SNC progridem e os distúrbios do sistema respiratório e cardiovascular se juntam; 3) nefrotóxico - no 2º-5º dia, a lesão renal predomina no quadro clínico da intoxicação. tratamento Lavagem gástrica com água ou solução de bicarbonato de sódio a 2%, seguida da introdução de 30 g de sulfato de magnésio em 200 ml de água. Dentro de 200 ml de uma solução a 30% de álcool etílico. 3-5 g de bicarbonato de sódio em 100 ml de água. Bebida abundante. Intramuscularmente 1-2 ml de cordiamina, 1 ml de uma solução de cafeína a 20%. Por via intravenosa 400 ml de solução de glicose a 5% com 5 ml de solução de ácido ascórbico a 5% e 8 UI de insulina, mistura de glicosona-vocaína, 400 ml de poliglucina, 400 ml de hemodez, 80-120 g de furosemida, 60-100 mg de prednisolona. 34. Intoxicação por dicloroetano As principais vias de entrada são o trato digestivo, o trato respiratório e a pele. A dose letal de DCE para humanos quando administrado por via oral é de 10-20 ml. O efeito tóxico do DCE é devido ao efeito narcótico no sistema nervoso central, danos ao fígado, rins, trato gastrointestinal e um efeito pronunciado no sistema cardiovascular. No quadro clínico, os principais sintomas são: encefalopatia tóxica, gastrite e gastroenterite tóxica aguda, respiração externa prejudicada, hepatite tóxica, função renal prejudicada. Nas primeiras horas após a administração, aparecem tonturas, ataxia, agitação psicomotora, convulsões tônicas clônicas, depressão da consciência, até coma. Um dos primeiros sinais de envenenamento são distúrbios gastrointestinais na forma de náuseas, vômitos repetidos com uma mistura de bile. A violação da função da respiração externa geralmente ocorre de acordo com o tipo de aspiração obstrutiva e está associada ao aumento da salivação, broncorréia e aspiração. Inibição da função do centro respiratório, o desenvolvimento de hipertonicidade dos músculos respiratórios e rigidez do tórax são observados. tratamento Em caso de envenenamento por vapor - a remoção da vítima da área afetada, com depressão respiratória do ventilador. Se o veneno entrar - lavagem gástrica através de uma sonda grossa, seguida da introdução de 3-4 colheres de sopa de carvão ativado em pó em 200 ml de água e 150-200 ml de óleo de vaselina, enema de sifão. Por via intravenosa 20-40 ml de uma solução de tiossulfato de sódio a 30%, por via intramuscular 5 ml de uma solução de unitiol a 5%. por via intravenosa 400 ml de poliglucina, 400 ml de hemodez, 400 ml de solução de glicose a 5%, 80-120 mg de furosemida (lasix), 6-8 ml de solução de ácido ascórbico a 5%. Intramuscularmente 2 ml de cordiamina, com colapso - 1 ml de uma solução de mezaton a 1%, 1 ml de uma solução de cafeína a 20%, 100-150 mg de prednisolona. Com um aumento da insuficiência hepática-renal, a terapia específica é realizada. Bolus intravenoso 400 ml de poliglucina, 400 ml de hemodez, 400 ml de glicose a 5%, 80-120 mg de furosemida, 6-8 ml de ácido ascórbico a 5%, 100-150 mg de prednisolona, para colapso 1 ml de 1% metátono. Por via intramuscular, 2-4 ml de brometo de tiamina a 6% e 2-4 ml de piridoxina a 5%. Para agitação psicomotora, 1 ml de solução de fenozepam a 3%. Inalação de oxigênio, em caso de depressão respiratória - ventilação mecânica através de tubo respiratório. Durante o primeiro dia, o método mais eficaz e econômico é a diálise peritoneal. A composição da solução de diálise padrão inclui: cloreto de potássio 0,3 g, cloreto de sódio 8,3 g, cloreto de magnésio 0,1 g, cloreto de cálcio 0,3 g, glicose 6 g por 1 litro de água. Ao mesmo tempo, são injetados na cavidade abdominal do paciente até 2 litros de solução eletrolítica com adição de 500 mil unidades de penicilina e 1000 unidades de heparina. 35. Envenenamento com veneno de cogumelo e veneno de cobra Após um período latente que dura de 1-2 a 36 horas, aparecem cólicas abdominais, salivação, náuseas, vômitos indomáveis, diarréia, desidratação, colapso, delírio, alucinações, convulsões. No 2-3º dia - os fenômenos de insuficiência renal-hepática com anúria, azotemia, icterícia. Em envenenamento grave com linhas e cogumelos, a hemólise é possível. tratamento Lavagem gástrica através de tubo grosso, seguida da introdução de 3-4 colheres de sopa de carvão ativado em pó em 200 ml de água e 30 g de sulfato de magnésio (sódio) em 100 ml de água, enema sifão. Subcutaneamente 1 ml de uma solução de atropina a 0,1%, 2 ml de cordiamina. No envenenamento por morel, a atropina não é usada como antídoto. 400 ml de poliglucina por via intravenosa, 400 ml de gemodez, 400 ml de solução de glicose a 5% com 4-6 ml de solução de ácido ascórbico a 5%, 80-120 mg de furosemida (lasix). Intramuscularmente 1-2 ml de uma solução de brometo de tiamina a 6% e 2 ml de uma solução de cloridrato de piridoxina a 5% (não injetar em uma seringa). Alívio da síndrome da dor por via intramuscular com a introdução de 1 ml de uma solução de 0,2% de platifilina, 2 ml de uma solução de 2% de papaverina. Com convulsões, agitação psicomotora - intramuscularmente 1-2 ml de uma solução de fenozepam a 3% ou uma mistura lítica (1-2 ml de uma solução de clorpromazina a 2,5%, 1-2 ml de uma solução de difenidramina a 1%, 5-10 ml de solução de sulfato de magnésio a 25 %) sob controlo da pressão arterial. Forçando a diurese. Em casos graves - hemossorção, hemodiálise precoce. Terapia sintomática. Intoxicação por veneno de cobra Dor e inchaço que se espalha rapidamente no local da picada, sonolência, depressão respiratória, colapso, hemólise intravascular com hemoglobinúria, hemorragias subcutâneas graves, às vezes convulsões. Possivelmente insuficiência renal. Com uma picada de cobra, as alterações locais são menos pronunciadas, predominam distúrbios bulbares (distúrbios da fala e deglutição, ptose, paralisia dos músculos motores) e depressão respiratória. tratamento Aspirar sangue e linfa da ferida (no máximo 30-60 minutos após a picada) formada no local da picada usando um frasco para sugar sangue. Enxaguar a ferida com solução de permanganato de potássio a 1%. Injeção na ferida de 0,3-0,5 ml de uma solução de adrenalina a 0,1%. Se possível, administração urgente de soro específico anti-cobra mono ou polivalente após administração intravenosa preliminar de 100-150 ml de hidrocortisona ou 50-100 ml de prednisolona. Em caso de picadas de cobra - soro Anticobra intravenoso na dose de 300 ml em combinação com 1 ml de solução de prozerina a 0,05% e administração repetida a cada 30 minutos com 1 ml de solução de atropina a 0,1%. 36. Intoxicação por ácido e arsênico A inalação de vapores causa irritação dos olhos e do trato respiratório superior (lacrimação, coriza, tosse, falta de ar). Parada respiratória reflexa é possível. Após um período latente (de 2 a 24 horas), forma-se pneumonia tóxica ou edema pulmonar tóxico. Em golpe em olhos, em pele - queimaduras químicas. Quando ingerido - uma queimadura química da cavidade oral, faringe, esôfago, estômago, possível inchaço da laringe com insuficiência respiratória. Vômitos repetidos com sangue, irritação peritoneal e, ocasionalmente, perfuração do esôfago ou estômago. Colapso, choque, síndrome hemorrágica. Possível hemólise intravascular, nefrose hemoglobinúrica com insuficiência renal aguda (renal-hepática). A lavagem gástrica tubeless e o vômito artificial são perigosos devido à possibilidade de re-queima do esôfago e aspiração de ácido. Não injete laxantes salinos e soluções alcalinas. tratamento Lavagem gástrica através de uma sonda grossa com água fria após uma injeção intravenosa ou intramuscular preliminar de 1-2 ml de uma solução de promedol a 2%. Dentro de pedaços de gelo, Almagel A 15-20 ml a cada hora. 800 ml de poliglucina por via intravenosa, 400 ml de hemodez, mistura de glucosona-vocaína (400 ml de solução de glicose a 5% com 25 ml de solução de novocaína a 2%), 50-150 mg de prednisolona ou 150-250 mg de hidrocortisona, 10 mil unidades de heparina, 80-120 mg de furosemida (Lasix). O alívio da dor é obtido por injeção intravenosa de 1-2 ml de solução de fentanil 0,005% e 2-4 ml de solução de droperidol 0,25%, para dor abdominal persistente - injeção intramuscular de 1-2 ml de solução de platifilina 0,2%, 2 ml de 2 % solução de papaverina. Inalação de oxigênio com agente antiespumante. Com o aumento do inchaço da laringe - por via intravenosa 200-400 mg de prednisolona, 1-2 ml de uma solução de difenidramina a 1%, 10-20 ml de uma solução de aminofilina a 2,4%, 1-2 ml de uma solução de efedrina a 5% . Se não houver efeito, traqueostomia, inalação de oxigênio e, se indicada, ventilação mecânica. Envenenamento por arsênico e seus compostos: gosto metálico na boca, dor abdominal, vômitos, fezes moles, desidratação grave, convulsões, taquicardia, diminuição da pressão arterial, coma, insuficiência renal aguda. Hemólise intravascular e hemoglobinúria se desenvolvem no envenenamento por hidrogênio arsênico. tratamento Lavagem gástrica por sonda grossa (2-3 vezes ao dia) com introdução no início e no final da lavagem de 50 ml de uma solução de unitiol a 5%, repetir enemas de sifão com adição de unitiol. Continuação da terapia com antídotos por via intravenosa ou intramuscular com a introdução de uma solução de unitiol a 5% (até 300 ml por dia), gotejamento endovenoso de 20 ml de tetacina de cálcio a 10% (ED1A) em 400 ml de uma solução de glicose a 5%. 37. Envenenamento com álcali, atropina, cannabis envenenamento alcalino Quando ingerido, desenvolve-se uma queimadura química da membrana mucosa da cavidade oral, esôfago e estômago. Dor ao longo do esôfago e no abdômen, vômito com uma mistura de sangue, sangramento esofágico-gástrico. Possível perfuração do esôfago, estômago com o desenvolvimento de mediastinite, peritonite. Com uma queimadura da laringe - rouquidão da voz, afonia, dificuldade (estridor) para respirar. Em casos graves - choque de queimadura, oligúria. O contato com a pele causa queimaduras químicas. Trate como no envenenamento por ácido. Intoxicação por atropina Boca seca, rouquidão, pele seca e hiperêmica, pupilas dilatadas, falta de ar, palpitações, taquicardia, sede, náusea, dificuldade para urinar. Em envenenamento grave - agitação psicomotora, delírio, alucinações, convulsões, distúrbios do ritmo cardíaco, coma, colapso são possíveis. tratamento Se necessário - lavagem gástrica através de uma sonda grossa, ricamente lubrificada com óleo de vaselina, a introdução de 3-4 colheres de sopa. eu. carvão ativado em pó em 200 ml de água e 30 mg de sulfato de magnésio em 100 ml de água. intravenosamente 2-4 ml de solução de proserina a 0,05%, 400-800 ml de solução de glicose a 5%, 40-80 mg de furosemida (lasix). Bebida abundante. Alívio da agitação psicomotora e convulsões por via intramuscular, administrando 1-2 ml de uma solução de fenozepam a 3% ou uma mistura lítica (2 ml de uma solução de aminazina a 2,5%, 2 ml de uma solução de difenidramina a 1% e 10 ml de um 25 % solução de sulfato de magnésio) ou 1-2 g de hidrato de cloral em um enema com 1-2 g de amido por 25-50 ml de água, por via intravenosa 10-15 ml de uma solução de hidroxibutirato de sódio a 20%, 2-4 ml de uma solução de seduxen a 0,5%. Com taquicardia grave, extra-sístole - anaprilina intravenosa (1-2 ml de uma solução a 0,25%) ou um comprimido de anaprilina (40 mg) sob a língua. Com colapso - intravenosamente 1 ml de uma solução a 1% de mezaton em 10 ml de uma solução a 0,9% de cloreto de sódio. Com uma hipertermia aguda - intramuscularmente 2 ml de uma solução a 50% de analgin, bolsas de gelo em grandes vasos e na cabeça, envoltórios molhados. Envenenamento por cannabis (haxixe, maconha, maconha, plano) Há euforia, agitação psicomotora, alucinações visuais vívidas, pupilas dilatadas, zumbido. Posteriormente, fraqueza, letargia, depressão do humor, sonolência, bradicardia, hipotermia. tratamento Em caso de intoxicação oral - lavagem gástrica através de uma sonda grossa, seguida da introdução de 3-4 colheres de sopa. eu. carvão ativado em pó em 200 ml de água. Por via intravenosa 400-800 ml de uma solução de glicose a 5% com 5-10 ml de uma solução de ácido ascórbico a 5% e 8-16 unidades de insulina, 40-80 mg de furosemida (lasix), por via intramuscular 2 ml de uma solução a 6% de brometo de tiamina. 38. Envenenamento com cocaína, dicaína, analgésicos narcóticos envenenamento por cocaína Manifesta-se clinicamente por agitação geral, dor de cabeça, rubor facial, pupilas dilatadas, taquicardia, aumento da respiração, aumento da pressão arterial, alucinações. Em casos graves - convulsões, coma, paralisia respiratória, colapso. Lavagem gástrica repetida através de sonda grossa com solução de permanganato de potássio a 0,1%, seguida da introdução de 3-4 colheres de sopa. eu. carvão ativado em pó em 200 ml de água e 30 g de sulfato de magnésio em 100 ml de água. 400 ml de gemodez por via intravenosa, 400 ml de solução de glicose a 5% com 5-10 ml de solução de ácido ascórbico a 5%, 40-80 mg de furosemida (lasix). Quando excitado - fixando a vítima, intramuscularmente 1-2 ml de uma solução de fenozepam a 3% ou uma mistura lítica (1-2 ml de uma solução de clorpromazina a 2,5%, 2 ml de uma solução de difenidramina a 1% e 5-10 ml de 25% - uma solução de sulfato de magnésio) sob o controle da pressão arterial. Com convulsões, 1-2 g de hidrato de cloral é administrado em um enema com 1-2 g de amido em 25-50 ml de água, intravenosamente lentamente 15-20 ml de uma solução de oxibutirato de sódio a 20%, se não houver efeito, lentamente por via intramuscular até 20 ml de solução a 2,5% de tiopental sódico ou hexenal. Com o desenvolvimento de um coma, uma bolsa de gelo na cabeça, por via intravenosa 40 ml de uma solução de glicose a 40% com 4-6 ml de uma solução de ácido ascórbico a 5% e 8 unidades de insulina, lentamente por via intravenosa ou intramuscular 2-4 ml de uma solução de brometo de tiamina a 6% e 2-4 ml de uma solução de cloridrato de piridoxina a 5%, 80-120 mg de furosemida. Com depressão respiratória grave, a ventilação mecânica é realizada, por via intravenosa lenta, 2 ml de cordiamina, inalação de oxigênio. Intoxicação com analgésicos narcóticos (morfina, onopon, droperidol) Sonolência ou inconsciência, constrição pupilar, hipertonicidade muscular (às vezes convulsões), depressão respiratória, bradicardia, colapso. A paralisia respiratória é possível com a consciência do paciente preservada. Lavagem gástrica através de uma sonda grossa (mantendo a consciência), seguida pela introdução de 3-4 colheres de sopa. eu. carvão ativado em pó e 30 g de sulfato de sódio, enema com sifão. 400 ml de gemodez por via intravenosa, 400 ml de poliglucina, 400 ml de solução de glicose a 5%, 60-80 mg de furosemida (lasix). Subcutaneamente 1-2 ml de uma solução de atropina a 0,1%, 1-2 ml de cordiamina, 1 ml de uma solução de cafeína a 20%. Com o desenvolvimento de um coma, uma bolsa de gelo na cabeça, por via intravenosa 40 ml de uma solução de glicose a 40% com 5-10 ml de uma solução de ácido ascórbico a 5% e 8 unidades de insulina, por via intravenosa lenta ou intramuscular 2-4 ml de uma solução de brometo de tiamina a 6% e 2-4 ml de uma solução de cloridrato de piridoxina a 5%, 80-120 mg de furosemida (lasix). Se necessário - cateterismo vesical e extração de urina. Com depressão respiratória - IVL, inalação de oxigênio. Hemossorção (2-3 vezes ao dia até que a consciência seja restaurada). 39. Dor A dor é um estado sensorial e emocional desagradável causado por efeitos patológicos reais ou potenciais nos tecidos. No SNC, a dor é conduzida por duas vias principais. Caminho específico - os cornos posteriores da medula espinhal, núcleos específicos do tálamo, o córtex do giro central posterior. Essa via é neuronal baixa, rápida, conduz a dor de limiar, emocionalmente incolor, precisamente localizada (dor epicrítica). Via não específica - os cornos posteriores da medula espinhal, núcleos não específicos do tálamo, o córtex dos lobos frontal e parietal difusamente. Conduz uma dor subliminar, emocionalmente colorida, mal localizada. É lento, multineuronal, pois forma numerosos colaterais para a medula oblonga, a formação reticular, o sistema límbico e o hipocampo. Os impulsos de dor subliminares sofrem somação no tálamo. Impulsos conduzidos ao longo da via inespecífica da dor excitam os centros emocionais do sistema límbico, os centros autônomos do hipotálamo e a medula oblonga. Portanto, a dor é acompanhada de medo, experiências dolorosas, aumento da respiração, pulso, aumento da pressão arterial, dilatação da pupila, distúrbios dispépticos. A ação do sistema de dor nociceptiva é neutralizada pelo sistema antinoceceptivo, cujos neurônios principais estão localizados na substância cinzenta periaquedutal (o aqueduto de Sylvius conecta os ventrículos III e IV). Seus axônios formam vias descendentes para a medula oblonga e medula espinhal e vias ascendentes para a formação reticular, tálamo, hipotálamo, sistema límbico, gânglios da base e córtex. Os mediadores desses neurônios são os pentapeptídeos: metenencefalina e leuencefalina, que possuem metionina e leucina como aminoácidos terminais, respectivamente. As encefalinas excitam os receptores opiáceos. Nas sinapses encefalinérgicas, os receptores opiáceos estão localizados na membrana pós-sináptica, mas a mesma membrana é pré-sináptica para outras sinapses. Os receptores opiáceos estão associados à adenilato ciclase e causam sua inibição por interromper a síntese de AMPc nos neurônios. Como resultado, a entrada de cálcio e a liberação de mediadores, incluindo mediadores da dor - peptídeos diminuem: substância P, colecistocinina, somatostatina, ácido glutâmico. Os receptores opiáceos são excitados não apenas por mediadores - encefalinas, mas também por outros componentes do sistema antinoceceptivo - hormônios cerebrais (endorfinas). Agonistas peptídicos de receptores opiáceos são formados durante a proteólise das substâncias peptídicas do cérebro: proopiocortina, proencefalinas A e B. Todos esses peptídeos são formados no hipotálamo. Os receptores opiáceos excitam os receptores em todas as estruturas cerebrais envolvidas na condução e percepção da dor, a formação de reações emocionalmente coloridas à dor. Ao mesmo tempo, a liberação de mediadores da dor diminui e todas as reações que acompanham a dor são enfraquecidas. 40. Medicamentos analgésicos Um analgésico (ácido acetilsalicílico, paracetamol, morfina) é um medicamento que reduz a dor de várias origens. Medicamentos que reduzem a dor provocada apenas por um determinado fator causador ou eliminam uma síndrome dolorosa específica, por exemplo, antiácidos, ergotamina (enxaqueca), carbamazepina (nevralgia), nitroglicerina (angina pectoris), não pertencem aos analgésicos clássicos. Os corticosteróides suprimem a resposta inflamatória e a dor resultante, mas apesar de seu uso generalizado para esses fins, eles também não representam analgésicos clássicos. Os analgésicos são classificados em narcóticos, que atuam nas estruturas do SNC e causam sonolência, como os opioides, e não narcóticos, que atuam principalmente nas estruturas periféricas, como o paracetamol, ácido acetilsalicílico. Medicamentos adicionais que aumentam o efeito dos analgésicos Os medicamentos deste grupo não são analgésicos em si, mas são usados em combinação com analgésicos para dor, pois podem mudar a atitude em relação à dor, sua percepção e nível de ansiedade, medo, depressão (os antidepressivos tricíclicos podem até causar uma diminuição na necessidade de morfina em um paciente em estado terminal). Tais drogas podem ser drogas psicotrópicas, bem como aquelas que afetam os mecanismos da dor, por exemplo, eliminando o espasmo dos músculos lisos e estriados. Os analgésicos narcóticos são medicamentos fitoterápicos e sintéticos que reduzem seletivamente a percepção da dor, aumentam a tolerância à dor pela redução da coloração emocional da dor e seu acompanhamento vegetativo, causam euforia e dependência de drogas. Classificação dos analgésicos narcóticos e seus antagonistas 1. Derivados de piperidina-fenantreno: 1) morfina; 2) codeína (metilmorfina, 5-7 vezes mais fraca que a morfina como analgésico); 3) etilmorfina (dionina, igual em força à morfina). 2. Derivados de fenilpiperidina: 1) promedol (3-4 vezes mais fraco que a morfina); 2) fentanil (100-400 vezes mais forte que a morfina). 3. Derivados de difenilmetano: 1) piritramida (dipidolor) - igual a morfina; 2) tramadol (tramal) - um pouco inferior à morfina. 4. Agonistas-antagonistas: 1) agonistas de receptores de opiáceos e antagonistas de receptores de opiáceos - buprenorfina (norfina) (25-30 vezes mais forte que a morfina); 2) agonistas dos receptores opiáceos e antagonistas dos receptores opiáceos - pentazocina (lexir) (2-3 vezes mais fraco que a morfina) e butorfanol (moradol) (igual à morfina). 41. Etapas da anestesia A anestesia geral, ou anestesia, é um estado do corpo caracterizado por um desligamento temporário da consciência de uma pessoa, sua sensibilidade e reflexos à dor, bem como relaxamento dos músculos dos músculos esqueléticos, causado pela ação de analgésicos narcóticos sobre o sistema nervoso central. Dependendo das vias de administração de substâncias narcóticas no corpo, distinguem-se a anestesia inalatória e não inalatória. Existem 4 fases de anestesia: 1) analgesia; 2) excitação; 3) estágio cirúrgico, subdividido em 4 níveis; 4) estágio de despertar. Fase da analgesia O paciente está consciente, mas nota-se alguma letargia, está cochilando, responde a perguntas em monossílabos. A sensibilidade superficial e dolorosa estão ausentes, mas quanto à sensibilidade tátil e térmica, estão preservadas. Nesta etapa, são realizadas intervenções cirúrgicas de curta duração, como abertura de fleuma, abscessos, estudos diagnósticos, etc. A etapa é de curta duração, com duração de 3 a 4 minutos. Estágio de excitação Nesta fase, os centros do córtex cerebral são inibidos, e os centros subcorticais neste momento estão em estado de excitação. Ao mesmo tempo, a consciência do paciente está completamente ausente, é observada excitação motora e de fala pronunciada. Os pacientes começam a gritar, fazem tentativas de se levantar da mesa de operação. A hiperemia da pele é observada, o pulso se torna frequente, a pressão arterial sistólica aumenta. A pupila do olho fica larga, mas a reação à luz persiste, o lacrimejamento é notado. Muitas vezes há tosse, aumento da secreção brônquica, às vezes vômitos. A intervenção cirúrgica no contexto da excitação não pode ser realizada. Durante este período, você deve continuar a saturar o corpo com um narcótico para aumentar a anestesia. A duração do estágio depende do estado geral do paciente e da experiência do anestesiologista. Normalmente, a duração da excitação é de 7 a 15 minutos. Estágio cirúrgico Com o início desta fase da anestesia, o paciente se acalma, a respiração fica calma e uniforme, a frequência cardíaca e a pressão arterial se aproximam do normal. Durante este período, as intervenções cirúrgicas são possíveis. Dependendo da profundidade da anestesia, distinguem-se 4 níveis e estágio III da anestesia. Primeiro nível: o paciente está calmo, o número de movimentos respiratórios, o número de batimentos cardíacos e a pressão arterial estão se aproximando dos valores iniciais. A pupila gradualmente começa a se estreitar, sua reação à luz é preservada. Segundo nível: o movimento dos globos oculares é interrompido, eles são fixados em uma posição central. As pupilas se dilatam e sua reação à luz enfraquece. O tônus muscular é reduzido, o que permite operações abdominais. O terceiro nível é caracterizado como anestesia profunda. Ao mesmo tempo, as pupilas dos olhos são dilatadas com uma reação a um forte estímulo de luz. A anestesia no quarto nível representa risco de vida para o paciente, pois pode ocorrer parada respiratória e circulatória. Estágio do Despertar Assim que a introdução de drogas narcóticas para, sua concentração no sangue diminui e o paciente passa por todas as etapas da anestesia na ordem inversa, ocorre o despertar. 42. Preparando o paciente para anestesia O anestesiologista assume um papel direto e muitas vezes o principal na preparação do paciente para anestesia e cirurgia. Um momento obrigatório é o exame do paciente antes da operação, mas, ao mesmo tempo, é importante não apenas a doença de base, para a qual a cirurgia deve ser realizada, mas também a presença de doenças concomitantes, que o anestesiologista solicita detalhadamente . É necessário saber como o paciente foi tratado para essas doenças, o efeito do tratamento, a duração do tratamento, a presença de reações alérgicas, o tempo da última exacerbação. Se o paciente for submetido a uma intervenção cirúrgica de maneira planejada, será realizada, se necessário, a correção de doenças concomitantes existentes. A higienização da cavidade oral é importante na presença de dentes soltos e cariados, pois podem ser uma fonte adicional e indesejável de infecção. O anestesiologista descobre e avalia o estado psiconeurológico do paciente. Assim, por exemplo, na esquizofrenia, o uso de drogas alucinógenas (cetamina) é contraindicado. A cirurgia durante o período de psicose é contra-indicada. Na presença de déficit neurológico, ele é corrigido preliminarmente. A história alérgica é de grande importância para o anestesiologista; para isso, é especificada a intolerância a medicamentos, assim como a alimentos, produtos químicos domésticos, etc. Se o paciente tiver uma anemnese alérgica agravada, nem mesmo a medicamentos, durante a anestesia, pode se desenvolver uma reação alérgica até choque anafilático. Portanto, agentes dessensibilizantes (difenidramina, suprastina) são introduzidos na pré-medicação em grandes quantidades. Um ponto importante é a presença de um paciente nas operações anteriores e anestesia. Acontece que a anestesia foi e se houve alguma complicação. Chama-se a atenção para a condição somática do paciente: a forma do rosto, a forma e o tipo do tórax, a estrutura e o comprimento do pescoço, a gravidade da gordura subcutânea, a presença de edema. Tudo isso é necessário para escolher o método correto de anestesia e drogas. A primeira regra para preparar um paciente para anestesia durante qualquer operação e ao usar qualquer anestesia é a limpeza do trato gastrointestinal (o estômago é lavado pela sonda, são realizados enemas de limpeza). Para suprimir a reação psicoemocional e suprimir a atividade do nervo vago, antes da cirurgia, o paciente recebe medicação - pré-medicação. À noite, o fenazepam é prescrito por via intramuscular. Pacientes com sistema nervoso lábil são prescritos tranquilizantes (seduxen, relanium) um dia antes da cirurgia. 40 minutos antes da cirurgia, analgésicos narcóticos são administrados por via intramuscular ou subcutânea: 1 ml de uma solução de promolol a 1-2% ou 1 ml de pentozocina (lexir), 2 ml de fentanil ou 1 ml de morfina a 1%. Para suprimir a função do nervo vago e reduzir a salivação, administra-se 0,5 ml de uma solução de atropina a 0,1%. 43. Anestesia intravenosa e inalatória As vantagens da anestesia geral intravenosa são a rápida introdução do paciente na anestesia. Com esse tipo de anestesia, não há excitação e o paciente adormece rapidamente. Mas os narcóticos usados para administração intravenosa criam anestesia de curto prazo, portanto não podem ser usados em sua forma pura como mononarcose para operações de longo prazo. Os barbitúricos - tiopental sódico e hexenal - são capazes de induzir rapidamente o sono narcótico, enquanto não há estágio de excitação e o despertar é rápido. Os quadros clínicos da anestesia realizada com tiopental sódico e hexenal são semelhantes. Geksenal tem um efeito menos inibitório no centro respiratório. São utilizadas soluções recém-preparadas de derivados de ácido barbitúrico. Na cirurgia, a anestesia com barbitúricos como mononarcose é usada para operações de curta duração que não excedem 20 minutos de duração (por exemplo, abertura de abscessos, flegmão, redução de luxações, manipulações diagnósticas e reposicionamento de fragmentos ósseos). Derivados do ácido barbitúrico também são usados para anestesia de indução. O hidroxibutirato de sódio é administrado por via intravenosa muito lentamente. A droga cria uma anestesia superficial, por isso é frequentemente usada em combinação com outras drogas narcóticas, como barbitúricos - propanidida. É frequentemente usado para anestesia de indução. A cetamina pode ser usada para mononarcose e para anestesia de indução. A droga causa sono superficial, estimula a atividade do sistema cardiovascular (aumento da pressão arterial, o pulso acelera). A anestesia por inalação é realizada com a ajuda de líquidos (voláteis) de fácil evaporação - éter, halotano, metoxiflurano (pentano), tricloroetileno, clorofórmio ou substâncias narcóticas gasosas - óxido nitroso, ciclopropano. Com o método de anestesia endotraqueal, a substância narcótica entra no corpo da máquina de anestesia através de um tubo inserido na traqueia. A vantagem do método é que proporciona desobstrução das vias aéreas e pode ser utilizado em operações no pescoço, face, cabeça, elimina a possibilidade de aspiração de vômito, sangue; reduz a quantidade de droga usada; melhora a troca gasosa reduzindo o espaço "morto". A anestesia endotraqueal é indicada para grandes intervenções cirúrgicas, é utilizada como anestesia multicomponente com relaxantes musculares (anestesia combinada). O uso total de vários medicamentos em pequenas doses reduz os efeitos tóxicos no organismo de cada um deles. A anestesia mista moderna é usada para fornecer analgesia, desligar a consciência, relaxamento. A analgesia e o desligamento da consciência são realizados com o uso de uma ou mais substâncias narcóticas - inaladas ou não inaladas. A anestesia é realizada no primeiro nível do estágio cirúrgico. O relaxamento muscular, ou relaxamento, é obtido pela administração fracionada de relaxantes musculares. 44. Etapas da anestesia Existem três fases de anestesia. 1. Introdução à anestesia. A anestesia introdutória pode ser realizada com qualquer substância narcótica, contra a qual ocorre um sono anestésico bastante profundo sem estágio de excitação. Principalmente, são usados barbitúricos, fentanil em combinação com sombrevina, moídos com sombrevina. Tiopental sódico também é frequentemente usado. As drogas são usadas na forma de uma solução a 1%, são administradas por via intravenosa na dose de 400-500 mg. No contexto da anestesia de indução, relaxantes musculares são administrados e a intubação traqueal é realizada. 2. Manutenção da anestesia. Para manter a anestesia geral, você pode usar qualquer narcótico que possa proteger o corpo do trauma cirúrgico (halotano, ciclopropano, óxido nitroso com oxigênio), bem como neurolepta-nalgesia. A anestesia é mantida no primeiro e segundo níveis do estágio cirúrgico, e relaxantes musculares são administrados para eliminar a tensão muscular, que causa mioplegia de todos os grupos musculares esqueléticos, incluindo os respiratórios. Portanto, a principal condição para o moderno método combinado de anestesia é a ventilação mecânica, que é realizada apertando ritmicamente uma bolsa ou pele ou usando um aparelho de respiração artificial. Recentemente, a neuroleptanalgesia mais comum. Com este método, óxido nitroso com oxigênio, fentanil, droperidol, relaxantes musculares são usados para anestesia. Anestesia introdutória intravenosa. A manutenção da anestesia é feita por inalação de óxido nitroso com oxigênio na proporção de 2:1, administração intravenosa fracionada de fentanil e droperidol 1-2 ml a cada 15-20 minutos. Com o aumento da frequência cardíaca, o fentanil é administrado, com aumento da pressão arterial - droperidol. Este tipo de anestesia é mais seguro para o paciente. O fentanil aumenta o alívio da dor, o droperidol suprime as reações vegetativas. 3. Retirada da anestesia. Ao final da operação, o anestesiologista interrompe gradualmente a administração de substâncias narcóticas e relaxantes musculares. A consciência volta ao paciente, a respiração independente e o tônus muscular são restaurados. Os critérios para avaliar a adequação da respiração espontânea são indicadores de PO2, PCO2 e pH. Após o despertar, restabelecimento da respiração espontânea e do tônus muscular esquelético, o anestesiologista pode extubar o paciente e transportá-lo para posterior observação na sala de recuperação. Durante a anestesia geral, os principais parâmetros hemodinâmicos são constantemente determinados e avaliados. Meça a pressão arterial, a pulsação a cada 10-15 minutos. Em pessoas com doenças do sistema cardiovascular, bem como durante operações torácicas, é necessário monitorar constantemente a função do músculo cardíaco. A observação eletroencefalográfica pode ser usada para determinar o nível de anestesia. Para controlar a ventilação pulmonar e as alterações metabólicas durante a anestesia e a cirurgia, é necessário estudar o estado ácido-base (PO2, PCO2, pH, BE). 45. Complicações da anestesia Complicações durante a anestesia podem ocorrer devido à técnica inadequada de anestesia ou ao efeito dos anestésicos em órgãos vitais. Uma dessas complicações é o vômito. No início da introdução da anestesia, o vômito pode estar associado à natureza da doença dominante (estenose pilórica, obstrução intestinal) ou ao efeito direto da droga no centro do vômito. No contexto do vômito, a aspiração é perigosa - a entrada do conteúdo gástrico na traqueia e nos brônquios. O conteúdo gástrico que tem uma reação ácida pronunciada, caindo nas cordas vocais e depois penetrando na traqueia, pode levar a laringoespasmo ou broncoespasmo, resultando em insuficiência respiratória com hipóxia subsequente - é a chamada síndrome de Mendelssohn, acompanhada de cianose, broncoespasmo, taquicardia. Perigoso pode ser a regurgitação - lançamento passivo do conteúdo gástrico na traqueia e nos brônquios. Complicações do sistema respiratório podem ocorrer devido à permeabilidade das vias aéreas prejudicada. Isso pode ser devido a defeitos na máquina de anestesia. As complicações da intubação traqueal realizada por laringoscopia direta podem ser agrupadas da seguinte forma: 1) danos nos dentes pela lâmina do laringoscópio; 2) danos nas cordas vocais; 3) introdução de tubo endotraqueal no esôfago; 4) introdução de tubo endotraqueal no brônquio direito; 5) saída do tubo endotraqueal da traqueia ou dobrando-o. Distúrbios do ritmo cardíaco (taquicardia ventricular, extra-sístole, fibrilação ventricular) podem ocorrer devido a vários motivos: 1) hipóxia e hipercapnia decorrentes de intubação prolongada ou ventilação insuficiente durante a anestesia; 2) overdose de substâncias narcóticas - barbitúricos, halotano; 3) o uso de adrenalina em contexto de fluorotano, que aumenta a sensibilidade do fluorotano às catecolaminas. Danos nos nervos periféricos Esta complicação ocorre um dia ou mais após a anestesia. Na maioria das vezes, os nervos das extremidades superiores e inferiores e o plexo braquial são danificados. Isso é resultado de uma posição incorreta do paciente na mesa de operação (abdução do braço a mais de 90º do corpo, colocação do braço atrás da cabeça, fixação do braço no arco da mesa de operação, apoio das pernas na suportes sem estofamento). A posição correta do paciente na mesa elimina a tensão dos troncos nervosos. O tratamento é realizado por um neuropatologista e um fisioterapeuta. 46. Anestesia local Anestesia de superfície Esse tipo de anestesia é realizado pelo contato da substância anestésica com um ou outro órgão, sua superfície. Para isso, são utilizadas uma solução de cocaína a 1-3%, uma solução de dicaína a 0,25-2%, uma solução de lidocaína a 1-2%, uma solução de trimecaína a 1-5% e uma solução a 0,5-2%. solução. A maioria dos anestésicos locais se liga a canais de sódio inativados, impedindo sua ativação e entrada de sódio na célula durante a despolarização da membrana, obtendo assim um efeito analgésico. A técnica de anestesia de superfície é simples e consiste em lubrificar, instilar uma solução ou pulverizá-la com pistolas especiais. O início de ação do anestésico é dependente do pH, com pH baixo demorando mais para fazer efeito do que em pH alto. A duração da ação do anestésico depende do grau de sua ligação às proteínas. Este tipo de anestesia é usado em manipulações diagnósticas e em oftalmologia, otorrinolaringologia. Anestesia regional A anestesia regional inclui plexo, condução, epidural, paravertebral e outros tipos de anestesia. Ao contrário da anestesia geral, a anestesia regional proporciona analgesia cirúrgica adequada devido ao bloqueio periférico dos impulsos dolorosos, mantendo as funções vitais normais. A anestesia regional é tecnicamente difícil e requer conhecimento preciso da localização anatômica e topográfica do plexo nervoso ou condutor nervoso, orientação clara em pontos de identificação permanentes (saliências ósseas, artérias, músculos), capacidade de avaliar a resistência tecidual e as sensações do paciente. Para desligar a sensibilidade dolorosa, basta introduzir uma solução de trimecaína a 1% (lidocaína), e para desligar a sensibilidade proprioceptiva e conseguir o relaxamento muscular, devem ser utilizadas soluções anestésicas locais mais concentradas (por exemplo, trimecaína 2-2,5%) . A restauração da sensibilidade ocorre na ordem inversa, ou seja, primeiro aparecem o tônus muscular e as sensações proprioceptivas, e depois as sensações de dor e temperatura. O efeito da anestesia depende da quantidade de anestésico que penetra transperineuralmente e causa um bloqueio de limiar adequado. Dobrar a concentração do anestésico injetado prolonga a anestesia em 1/3 e a introdução de um volume duplo - apenas 3-9%. Os anestésicos locais muitas vezes levam a reações anafiláticas. Trimecaína: a duração da ação é de 1-1,5 horas, a dose única máxima é de 800-1000 mg. A lidocaína (xicaína) é usada em uma solução de 1-2%, a duração da anestesia é de até 2,5-3 horas. A bupivocaína (marcaína) é usada em uma solução de 0,5-0,75% em uma dose única máxima de 150-170 mg , duração da ação 8-12 horas Para o uso de anestésicos de ação prolongada, a adição de lidocaína acelera claramente o início do efeito, reduzindo o período de latência. 47. Anestesia do plexo cervical (ASP) O ACS, realizado em um ou ambos os lados, permite realizar todas as operações no pescoço, glândula tireoide, vasos braquiocefálicos em caso de ferimentos por arma de fogo, lesões e doenças tumorais. O plexo cervical (us cervicalis) é formado pelos ramos anteriores dos quatro nervos cervicais superiores (C1-C4) à medida que emergem dos forames intervertebrais. Está localizado na superfície anterior do músculo escaleno médio e do músculo que levanta a escápula, lateral aos processos transversos das vértebras cervicais. Os nervos motores do plexo cervical inervam os músculos do pescoço e os nervos sensoriais - a pele da região occipital da cabeça, as superfícies anterior e lateral do pescoço, a região subclávia ao nível das costelas I e II e a aurícula. O maior nervo do plexo cervical é o frênico (p. prenicus), que é formado a partir de C3-C4 e menos frequentemente devido a um ramo adicional de C5. A maioria dos nervos sensoriais sai no meio da borda posterior do músculo esternocleidomastóideo e diverge nas camadas superficiais do pescoço, pele da região occipital da cabeça e parte superior do tórax. Técnica de anestesia 2 cm abaixo do ângulo do maxilar inferior, anterior ao músculo esternocleidomastóideo, determina-se a pulsação da artéria carótida interna. O ramo horizontal do osso hióide corresponde ao nível do processo transverso da vértebra C3. O ponto de injeção da agulha está localizado na interseção da linha, que é uma continuação do ramo horizontal do osso hióide, com a borda anterior do músculo esternocleidomastóideo. Nesse ponto de intersecção, sob condições assépticas, forma-se uma “casca de limão” e uma agulha de injeção é direcionada por ela de fora para dentro e de frente para trás, avançando medialmente ao músculo esternocleidomastóideo e atrás da carótida interna (no espaço entre o músculo esternocleidomastóideo e a artéria carótida interna palpável) até que o paciente desenvolva parestesia ou a agulha atinja o processo transverso da vértebra C3. A profundidade da injeção não excede 2-5 cm. A agulha é firmemente fixada nesta posição e um teste de aspiração é realizado, determinando se a extremidade da agulha está no lúmen do vaso. Para anestesia, 10-12 ml de uma solução de 2% de trimecaína são injetados de ambos os lados. Para aumentar a anestesia do plexo cervical, você pode bloquear adicionalmente os ramos superficiais que vão para a superfície anterior do pescoço. O local de sua saída é o meio da borda posterior do músculo esternocleidomastóideo. A agulha é injetada no ponto de sua saída sob a fáscia superficial do pescoço. Uma solução de trimecaína a 2% é administrada em uma quantidade de 3-5 ml cranialmente e caudalmente (em forma de leque). A anestesia adequada ocorre após 8 a 12 minutos e proporciona alívio eficaz da dor na maioria dos pacientes em 1,5 a 2 horas. 48. Anestesia do plexo braquial (APS) APS permite realizar todas as operações no membro superior, articulação do ombro, ombro, antebraço e mão: amputações, tratamento cirúrgico de feridas com reposição e fixação de fragmentos ósseos, operações em vasos sanguíneos e nervos, redução de luxação do ombro, etc. a frequência das intervenções cirúrgicas no membro superior, principalmente em tempo de guerra, levanta a questão dos métodos racionais de anestesia durante essas operações. Anestesia do plexo braquial por Winnie O paciente está deitado de costas, a cabeça é virada na direção oposta do local da punção, o queixo é trazido para a cintura escapular contralateral. A mão do lado da punção fica ao longo do corpo, levemente puxada para baixo. Pontos de referência: músculo esternocleidomastóideo, escaleno anterior, espaço intersticial, veia jugular externa, clavícula, cartilagem cricóide. Técnica de anestesia. A pele é tratada com solução anti-séptica. Posterior ao músculo esternocleidomastóideo, que contorna claramente com ligeira elevação da cabeça, ao nível da cartilagem cricóide, coloque as pontas dos dedos da mão esquerda sobre o músculo escaleno anterior. Com mais deslocamento lateral dos dedos em 0,5-1,5 cm, o espaço interescalênico é sentido entre os músculos escalenos anterior e médio. Torna-se mais pronunciado com uma respiração profunda, à medida que os músculos escalenos ficam tensos. Nas profundezas do espaço interescalênico, os processos transversos das vértebras cervicais são sentidos (uma sensação de resistência sólida) e, com o aumento da pressão com a ponta do dedo, muitas vezes é causada parestesia no ombro ou na cintura escapular; caudalmente, no espaço interescalênico, a artéria subclávia pode ser palpada. O espaço interescalênico na seção superior é atravessado pela veia jugular externa. O ponto de inserção da agulha fica na parte superior do espaço interescalênico, ao nível da cartilagem cricóide. Nesse ponto, forma-se uma “casca de limão”, e através dela a agulha é direcionada medialmente e levemente para baixo, de frente para trás (dorsalmente) até o processo transverso de C6 em um ângulo de 30º com o plano sagital. Quando a agulha se move para dentro a uma distância de 1,5-4 cm, ocorre parestesia e a ponta da agulha repousa sobre o processo transverso da 6ª vértebra cervical. Nesta posição, a agulha é fixada ou puxada para cima em 1-2 mm, e após um teste de aspiração, 30-40 ml de uma solução de trimecaína a 2% (lidocaína) ou uma solução de bupivocaína (marcaína) a 0,5-0,75% são injetado. Durante a injeção dos primeiros mililitros da solução anestésica local, o paciente sente dor de curta duração (“choque elétrico”), indicando o correto posicionamento da ponta da agulha. Na ausência de parestesia, pode-se verificar a posição da ponta da agulha injetando 0,5 ml de solução de cloreto de sódio a 0,9% retirada da geladeira. O aparecimento de sensação de dor no membro superior indica contato da solução fria com o nervo. 49. Anestesia de nervos periféricos na área do punho Para operações na mão, é necessário anestesiar os nervos ulnar, mediano e radial. Em todos os casos, a agulha é injetada no nível da prega proximal do punho. Durante a anestesia, o paciente fica de costas, na área do pulso, o braço é supinado e levemente dobrado. Pontos de referência: ulna estiloide, pisiforme, tendão flexor ulnar do carpo e tendão flexor longo do carpo. Anestesia do nervo ulnar Técnica de anestesia do ramo palmar do nervo ulnar. O ponto de inserção da agulha está no nível da prega proximal do carpo, medial ao tendão flexor ulnar do carpo. A agulha é inserida a uma profundidade de 1-2 cm através do tecido subcutâneo em direção ao osso pisiforme. Após o aparecimento da parestesia e se o teste de aspiração for negativo, fixar a agulha e injetar 3-5 ml de solução de trimecaína a 2%. Na ausência de parestesia, a agulha é avançada até entrar em contato com o osso e, ao ser retirada, é feita infiltração tecidual com solução de trimecaína a 2%. Técnica para anestesia do ramo dorsal do nervo ulnar. O ponto de injeção da agulha está no nível da interseção da prega proximal do punho com a borda medial do tendão do músculo flexor ulnar. A agulha é direcionada para o processo estilóide da ulna. Para obter parestesia, 3-5 ml de uma solução de 2% de trimecaína são injetados. Na ausência de parestesia, a agulha é removida e 5-10 ml de solução de trimecaína a 2% são infiltrados nos tecidos. anestesia do nervo mediano Técnica de anestesia. O ponto de injeção da agulha está localizado na linha da prega cutânea proximal do punho entre o tendão do músculo palmar longo e o flexor radial da mão. Após avanço perpendicular da agulha através do tecido subcutâneo até uma profundidade de 0,5-1 cm e obtenção de parestesia, a agulha é fixada e injetados 3-5 ml de solução de lidocaína a 2%. Se não for possível obter parestesia a uma profundidade de 1 cm, os tecidos são infiltrados em forma de leque com 5-10 ml de uma solução de trimecaína a 2% enquanto se retira lentamente a agulha. Anestesia do nervo radial Técnica de anestesia. O ponto de injeção fica ao nível da prega cutânea proximal do punho lateral à artéria radial na projeção da parte superior da "tabaqueira anatômica", é feita uma injeção e a agulha é direcionada para a "tabaqueira". Quando ocorre parestesia, a agulha é fixada, com teste de aspiração negativo, injeta-se 3-5 ml de solução de trimecaína a 2%. Na ausência de parestesia, 5-10 ml de solução de trimecaína a 2% são injetados em forma de leque nos tecidos subjacentes, criando uma "pulseira" de infiltração de 3-3,5 cm de comprimento dos tendões do extensor curto e abdutor longo do polegar de um lado, para o extensor longo do polegar - com o outro. 50. Anestesia de membro inferior Para realizar intervenções cirúrgicas no membro inferior, é necessário anestesiar todos os quatro nervos principais. Três deles - o nervo femoral, obturador e cutâneo externo da coxa - originam-se do plexo lombar, e o ciático é formado em parte pelo lombar e três ramos do plexo sacral. Técnica de anestesia. A pele é tratada com uma solução desinfetante. Forma-se uma "casca de limão" com solução anestésica, após o que a agulha é injetada sob o ligamento inguinal 1-1,5 cm abaixo deste e 0,5-1 cm lateral à artéria femoral palpável. A agulha é direcionada através do tecido subcutâneo um pouco na direção proximal sob o ligamento inguinal, onde a uma profundidade de 3-4 cm após a punção da fáscia, a agulha falha com perda de resistência e pode ocorrer parestesia, estendendo-se para a superfície anterior da coxa. Nesta posição, a agulha é fixada com o polegar e o indicador da mão esquerda, e a borda da palma da mão esquerda é pressionada com força sobre os tecidos moles da coxa distal à agulha e 35-40 ml de Solução de trimecaína a 1,5% é injetada. A pressão nos tecidos moles dura 1,5-2 minutos. Assim, a anestesia do nervo femoral com pinçamento transforma-se em anestesia do plexo lombar, realizada a partir da abordagem anterior. O efeito da anestesia dura 2-2,5 horas. A anestesia do plexo lombar pode ser realizada por via posterior, anestesiando simultaneamente os nervos femoral (L2-L4) e obturador (L2-L3), genitofemoral (L1-L2) e o nervo cutâneo femoral lateral (L2-L3) . A posição do paciente durante a anestesia é do lado saudável com as pernas dobradas. Pontos de referência: processo espinhoso da 4ª vértebra lombar (linha ligando as cristas ilíacas atrás); 3 cm caudal ao longo das cristas dos processos espinhosos do processo espinhoso da 4ª vértebra lombar e 5 cm lateral do último ponto. Técnica de anestesia. Do processo espinhoso da 4ª vértebra lombar na direção caudal, traça-se uma linha de 3 cm de comprimento, a partir da qual uma perpendicular de 5 cm de comprimento é restaurada lateralmente para cima. O ponto final da perpendicular, próximo à crista ilíaca, é o ponto de injeção da agulha. Depois de criar uma "casca de limão", uma agulha de 12-15 cm de comprimento é inserida perpendicularmente à pele até entrar em contato com o processo transverso da 5ª vértebra lombar. Cranialmente, deslizando para fora do processo transverso da 5ª vértebra lombar, a agulha penetra na espessura do músculo psoas quadrado. Ao mesmo tempo, é sentida resistência à introdução de uma solução com uma seringa (ou resistência elástica ocorre com a deformação da bolha de ar na seringa). A agulha é passada a uma profundidade onde há sensação de “perda de resistência” (ou a bolha de ar não se deforma). Este teste indica que a agulha está na fáscia entre o psoas quadrado e o psoas maior. A agulha é fixada nesta profundidade e 35-40 ml de uma solução de 1,5-2% de trimecaína (lidocaína) são injetados para obter anestesia. 51. Anestesia do nervo ciático Anestesia do nervo ciático por via anterior Técnica de anestesia. O paciente está deitado de costas. A espinha ilíaca ântero-superior e o ponto mais saliente do trocanter maior do fêmur estão conectados entre si por uma linha reta, e a partir do último ponto uma perpendicular é restaurada à superfície anterior da coxa. O comprimento da perpendicular é igual à distância entre a espinha ilíaca ântero-superior e o trocanter maior do fêmur. A extremidade desta perpendicular é o ponto de projeção. Na posição fisiológica do membro inferior, após tratar a pele com solução desinfetante e criar uma “casca de limão”, uma agulha de 12 a 15 cm de comprimento é direcionada verticalmente para baixo até repousar no trocanter menor do fêmur. Após a agulha deslizar do trocânter menor, sem alterar a direção principal, a agulha é passada ainda mais fundo - 4-5 cm até ocorrer parestesia. Caso não seja possível obter parestesia, a agulha é devolvida ao osso e, girando o membro para dentro em 7-10, a agulha é avançada novamente até que apareça parestesia no paciente. Anestesia do nervo ciático por via posterior Técnica de anestesia. O paciente deita-se sobre o lado saudável, o membro anestesiado é dobrado nas articulações do quadril e joelho em um ângulo de 45-60. Da parte mais saliente do trocanter maior do fêmur, uma linha reta é traçada até a espinha ilíaca póstero-superior, a partir do meio da qual uma perpendicular de 4-5 cm de comprimento é abaixada na direção caudal. A extremidade da perpendicular serve como ponto de projeção para o nervo ciático. A agulha é inserida em um ângulo de 90º em relação ao plano frontal do corpo do paciente e avançada até obter parestesia ou contato com o osso. Se necessário, a agulha é puxada para cima e inserida aproximadamente 0,5 cm lateral ou medial à injeção inicial. A obtenção de parestesia é obrigatória. São administrados 20-25 ml de uma solução de lidocaína (trimecaína) a 2%. A técnica de anestesia não mudará se o paciente estiver deitado de bruços. Anestesia na fossa poplítea Técnica de anestesia. O canto superior da fossa rombóide está no nível da borda superior da patela. O ponto de injeção situa-se 1-1,5 cm abaixo do ângulo superior da bissetriz rebaixada deste ângulo, formado por fora pelo tendão do bíceps femoral, por dentro pelos tendões dos músculos semimembranoso e semitendinoso da coxa. A direção do movimento da agulha é estritamente vertical com o paciente em decúbito ventral até que a parestesia do nervo tibial seja obtida. Na ausência de parestesia, a agulha é direcionada em forma de leque, puxando-a a cada vez até o nível do tecido subcutâneo. Após um teste de aspiração, 5-10 ml de uma solução de 2% de trimecaína são injetados. Para bloquear o nervo fibular comum a partir do mesmo ponto, a agulha é direcionada lateralmente em um ângulo de 30-45 em relação ao plano frontal. Depois de receber parestesia, 5-10 ml de uma solução de 2% de trimecaína são injetados. Não há complicações ou contra-indicações. 52. Complicações da anestesia regional Durante a AR, as complicações ocorrem muito raramente e podem ser divididas em dois grupos. 1. Específicos, que estão mais relacionados aos erros técnicos da metodologia: 1) injeção errônea de anestésico local no canal espinhal ou espaço epidural, por via intravenosa ou intra-arterial (com anestesia do plexo cervical, anestesia do plexo lombar com acesso inguinal); 2) punção de cavidades e órgãos (cavidade pleural, pulmão); 3) a formação de um hematoma com negligência de punção e dano a um grande vaso; hematoma comprime o tecido circundante ou feixe neurovascular; 4) hipotensão prolongada e grave que ocorre com rápida reabsorção do anestésico local; 5) trauma no plexo ou condutor nervoso com a ponta da agulha de injeção durante a manipulação grosseira; 6) ausência de efeito analgésico após anestesia de plexo ou condução. 2. Inespecífica, manifestada principalmente por reações gerais e locais do organismo à ação de um anestésico local na forma de reações tóxicas e alérgicas. Complicações inespecíficas podem se desenvolver dependendo do tempo, dose e local de administração do anestésico. Neste caso, predominam as lesões do sistema nervoso central ou cardiovascular. As complicações do SNC podem ser leves (limitadas apenas à excitação central) ou graves, que se manifestam pela inibição do SNC com possível paralisia total. A natureza das complicações não específicas: 1) uma overdose de anestésico com a administração simultânea de uma grande dose (mais de 1 g) de trimecaína ou lidocaína por via intra-arterial ou intravenosa; 2) reações alérgicas à introdução de um anestésico local, caracterizadas por um complexo de sintomas de distúrbios do sistema nervoso central e cardiovascular: ansiedade, consciência prejudicada, distúrbios da fala, espasmos musculares, convulsões, respiração profunda, distúrbio do ritmo cardíaco, expansão do QR, redução da pressão arterial, taquicardia , apnéia, assistolia; 3) complicações infecciosas devido ao processamento de má qualidade do campo cirúrgico no local da anestesia; 4) o desenvolvimento de hipotensão com anestesia de plexo e condução é muito menos comum do que com raquianestesia e peridural; 5) com a introdução de soluções concentradas de anestésicos locais em uma pequena porcentagem de casos, observa-se o desenvolvimento de bradicardia. 53. Anestesia lombar Bloqueio de acordo com Vishnevsky Este tipo de anestesia é obtido através da injeção de um anestésico no canal espinhal. A técnica de punção lombar é descrita na aula nº 2. As particularidades são que o nível de punção é mais alto (T12-1_1, L1-L2) e após a retirada do mandril da agulha, um anestésico é imediatamente injetado. O volume de anestésico é de 3-5 ml. Naropin é administrado em concentração de 0,5%, lidocaína - em 2%, marcaína - em 0,5%. A duração da anestesia é de 4 a 6 horas, este tipo de anestesia também causa hipotensão grave. Em um alto nível de anestesia (T12-L1), a insuficiência respiratória é possível. A complicação mais comum é a dor de cabeça. Bloqueio vagossimpático cervical de acordo com A. V. Vishnevsky O paciente é colocado sobre a mesa de costas para que a mão do lado do bloqueio proposto fique pendurada na borda da mesa. O músculo esternocleidomastóideo deve estar relaxado. Um rolo é colocado sob a cintura escapular, a cabeça é retraída na direção oposta; nesta posição, os contornos anatômicos do pescoço são bem delineados. O campo é tratado com lubrificação com álcool e iodo. O médico fica do lado do bloqueio de mesmo nome. O local da injeção é o ângulo formado pela interseção da borda posterior do músculo esternocleidomastóideo com uma veia. O dedo indicador da mão esquerda é colocado na borda posterior do músculo esternocleidomastóideo, acima do local onde cruza com a veia jugular externa. Pressionando fortemente um dedo neste local, eles tentam mover o feixe neurovascular para a linha média. Neste caso, o dedo sente facilmente a superfície anterior das vértebras cervicais. A injeção da agulha e seu avanço devem ser feitos lentamente, para cima e para dentro, sempre focando na superfície anterior da coluna. A agulha se move ao longo da solução de novocaína a 2% enviada em pequenas porções (3-0,25 cm), o que garante a segurança da injeção. A seringa durante a injeção é repetidamente removida da agulha para fins de controle. Tendo trazido a agulha para a vértebra, eles sentem como ela repousa contra ela. Em seguida, a pressão na agulha é enfraquecida, devido à qual ela se afasta 1-2 mm, após o que são injetados 40 a 60 ml de uma solução, que, espalhando-se em um infiltrado rastejante ao longo da aponeurose pré-vertebral, cobre o vago, simpático , e muitas vezes nervos frênicos, interrompendo (bloqueando) a transmissão de irritações da região pleuropulmonar. A eficácia do bloqueio vagossimpático é evidenciada pelo aparecimento do sintoma de Horner (estreitamento da pupila, estreitamento da fissura palpebral e retração do globo ocular). O ritmo respiratório e o pulso tornam-se menos frequentes, a falta de ar e a cianose diminuem e o estado geral melhora. Para evitar que a agulha penetre nos vasos do pescoço, o músculo esternocleidomastóideo com o feixe neurovascular subjacente deve ser movido com força suficiente com o dedo indicador para a linha média. É importante direcionar a agulha para cima e para dentro, pois movê-la na direção horizontal ameaça introduzir uma solução sob a aponeurose pré-vertebral e a complicação subsequente na forma de uma síndrome dolorosa que não cessa durante o dia. 54. Avaliação da gravidade do paciente Avaliação da condição somática do paciente. 1 ponto - pacientes cuja doença é localizada e, via de regra, não causa distúrbios sistêmicos, ou seja, pessoas praticamente saudáveis. 2 pontos - isso inclui pacientes com distúrbios não expressos que interrompem moderadamente a atividade vital do corpo sem mudanças pronunciadas na homeostase. 3 pontos - pacientes com distúrbios sistêmicos vitais que interrompem significativamente o funcionamento do corpo, mas não levam à incapacidade. 4 pontos - pacientes com distúrbios sistêmicos graves que representam alto risco à vida humana e levam à incapacidade. 5 pontos - pacientes cuja condição é considerada crítica, o risco de morte em 24 horas é alto. O volume e a natureza da intervenção cirúrgica: 1 ponto - pequenas operações para: remoção de tumores localizados superficialmente e localizados, abertura de pequenos abscessos, amputação de dedos das mãos e pés, ligadura e remoção de hemorroidas, apendicectomia e herniotomia sem complicações. 2 pontos - operações de gravidade moderada: remoção de tumores malignos localizados superficialmente que requerem intervenção prolongada; abertura de abcessos localizados em cavidades; amputação e desarticulação dos membros superiores e inferiores; operações em embarcações periféricas; apendicectomia complicada e herniotomia exigindo intervenção extensa; toracotomia e laparotomia de ensaio; outros semelhantes em complexidade e âmbito de intervenção. 3 pontos - intervenções cirúrgicas extensas: operações radicais nos órgãos abdominais (exceto as listadas acima); operações radicais nos órgãos da cavidade torácica. amputações de membros estendidos, como amputação transiliossacral; cirurgia cerebral. 4 pontos - operações no coração, grandes vasos e outras intervenções complexas realizadas em condições especiais (circulação artificial, hipotermia, etc.). Classificação do estado objetivo do paciente, desenvolvida pela American Society of Anesthesiologists (ASA). 1. Não há distúrbios sistêmicos. 2. Distúrbios sistêmicos leves sem comprometimento funcional. 3. Doenças sistêmicas moderadas e graves com disfunção. 4. Doença sistêmica grave que constantemente representa uma ameaça à vida e leva ao fracasso das funções. 5. Estado terminal, alto risco de morte durante o dia, independente da operação. 6. Morte encefálica, doação de órgãos para transplante. 55. Ventilação pulmonar artificial A ventilação pulmonar artificial (ALV) fornece trocas gasosas entre o ar circundante (ou uma certa mistura de gases) e os alvéolos dos pulmões, é usada como meio de ressuscitação em caso de interrupção súbita da respiração, como componente da anestesia e como meio de cuidados intensivos para insuficiência respiratória aguda, bem como algumas doenças do sistema nervoso e muscular. Os métodos modernos de ventilação pulmonar artificial (ALV) podem ser divididos em simples e de hardware. Um método simples de ventilação mecânica é geralmente usado em situações de emergência (apneia, ritmo patológico, respiração agonal, aumento da hipoxemia e (ou) hipercapnia e distúrbios metabólicos graves). Os mais simples são os métodos expiratórios de ventilação mecânica (respiração artificial) boca a boca e boca ao nariz. Os métodos de hardware são usados quando é necessária ventilação mecânica de longo prazo (de uma hora a vários meses e até anos). O respirador Phase-50 possui grandes capacidades. O dispositivo Vita-1 é produzido para prática pediátrica. O respirador é conectado ao trato respiratório do paciente através de um tubo endotraqueal ou cânula de traqueostomia. A ventilação do hardware é realizada no modo de frequência normal, que varia de 12 a 20 ciclos por minuto. Na prática, existem ventilações de alta frequência (mais de 1 ciclos por minuto), nas quais o volume corrente é significativamente reduzido (para 60 ml ou menos), a pressão positiva nos pulmões no final da inspiração é reduzida, bem como a pressão intratorácica pressão e o fluxo sanguíneo para o coração melhoram. Além disso, com o modo de alta frequência, a adaptação (adaptação) do paciente ao respirador é facilitada. Existem três métodos de ventilação de alta frequência: volumétrico, oscilatório e jato. O volume geralmente é realizado com uma frequência respiratória de 80-100 por 1 min, IVL oscilatório - 600-3600 por 1 min, o que garante a vibração de um fluxo de gás contínuo ou intermitente. A ventilação de alta frequência a jato mais difundida com uma frequência respiratória de 100-300 por minuto, na qual um jato de oxigênio a uma pressão de 1-2 atm é soprado nas vias aéreas através de uma agulha ou cateter com um diâmetro de 2-4 milímetros. Também é realizada ventilação auxiliar, mas neste caso a respiração espontânea do paciente é mantida. O gás é fornecido depois que o paciente faz uma tentativa fraca de inalar ou o paciente é sincronizado com um modo de operação do dispositivo selecionado individualmente. Existe também um modo de ventilação mandatória intermitente (VPP), que é utilizado no processo de transição gradual da ventilação artificial para a respiração espontânea. Nesse caso, o paciente respira por conta própria, mas adicionalmente um fluxo contínuo de mistura de gases é fornecido ao trato respiratório. Neste contexto, com uma frequência definida (de 10 a 1 vez por minuto), o dispositivo realiza inalação artificial, coincidente (PPVL sincronizada) ou não coincidente (PPVL não sincronizada) com a inalação espontânea do paciente. Uma redução gradual nas respirações artificiais prepara o paciente para uma respiração independente. 56. Terapia de infusão A terapia de infusão é uma injeção de gotejamento ou infusão intravenosa ou sob a pele de drogas e fluidos biológicos para normalizar o equilíbrio hidroeletrolítico e ácido-base do corpo, bem como para diurese forçada (em combinação com diuréticos). Indicações para terapia de infusão: todos os tipos de choque, perda de sangue, hipovolemia, perda de líquidos, eletrólitos e proteínas como resultado de vômitos indomáveis, diarréia intensa, recusa em ingerir líquidos, queimaduras, doença renal; violações do conteúdo de íons básicos (sódio, potássio, cloro, etc.), acidose, alcalose e envenenamento. As soluções cristalóides são capazes de compensar a deficiência de água e eletrólitos. Aplicar solução de cloreto de sódio 0,85%, soluções de Ringer e Ringer-Locke, solução de cloreto de sódio 5%, soluções de glicose 5-40% e outras soluções. São administrados por via intravenosa e subcutânea, por jato (com desidratação grave) e gotejamento, em um volume de 10-50 ml/kg ou mais. Os objetivos da terapia de infusão são: restauração do CBC, eliminação da hipovolemia, garantia do débito cardíaco adequado, manutenção e restauração da osmolaridade plasmática normal, garantia da microcirculação adequada, prevenção da agregação das células sanguíneas, normalização da função de transporte de oxigênio do sangue. Soluções coloidais são soluções de substâncias macromoleculares. Eles contribuem para a retenção de líquido no leito vascular. Hemodez, poliglucina, reopoliglicucina, reogluman são usados. Com sua introdução, são possíveis complicações, que se manifestam na forma de uma reação alérgica ou pirogênica. Vias de administração - por via intravenosa, menos frequentemente por via subcutânea e gotejamento. A dose diária não excede 30-40 ml/kg. Eles têm uma qualidade desintoxicante. Como fonte de nutrição parenteral, são usados em caso de recusa prolongada de comer ou incapacidade de se alimentar por via oral. Os dextranos são substitutos do plasma coloidal, o que os torna altamente eficazes na rápida recuperação do CBC. Os dextranos têm propriedades protetoras específicas contra doenças isquêmicas e reperfusão, cujo risco está sempre presente durante grandes intervenções cirúrgicas. O plasma fresco congelado é um produto retirado de um único doador. O FFP é separado do sangue total e congelado imediatamente dentro de 6 horas após a coleta do sangue. Armazenado a 30 C em sacos plásticos por 1 ano. Dada a labilidade dos fatores de coagulação, o PFC deve ser transfundido nas primeiras 2 horas após o descongelamento rápido a 37°C. A transfusão de plasma fresco congelado (PFC) apresenta um alto risco de contrair infecções perigosas, como HIV, hepatite B e C, etc. Frequência de reações anafiláticas e pirogênicas durante a transfusão de FFP é muito alta, portanto, a compatibilidade de acordo com o sistema ABO deve ser levada em consideração. E para mulheres jovens é necessário levar em conta a compatibilidade Rh. Autor: Kolesnikova M.A.
Couro artificial para emulação de toque
15.04.2024 Areia para gatos Petgugu Global
15.04.2024 A atratividade de homens atenciosos
14.04.2024
▪ Um buraco negro não pode se tornar mais pesado que 50 bilhões de sóis ▪ Os saquinhos de chá são perigosos para os seres humanos ▪ Estojos com sensor de impressão digital para dispositivos Android ▪ É hora de acabar com o tumulto com gasolina
▪ seção do site Firmware. Seleção de artigos ▪ artigo Imunologia geral e clínica. Berço ▪ artigo O que torna a comida saborosa? Resposta detalhada ▪ artigo Slide oito. Dicas de viagem ▪ artigo Bloqueio de código eletrônico. Enciclopédia de rádio eletrônica e engenharia elétrica ▪ artigo Carregador antigo. Enciclopédia de rádio eletrônica e engenharia elétrica
Página principal | Biblioteca | Artigos | Mapa do Site | Revisões do site www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

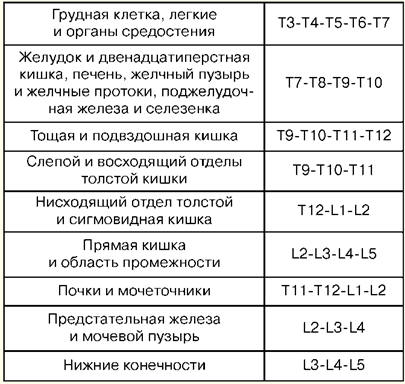


 Veja outros artigos seção
Veja outros artigos seção 