
|
|
RESUMO DA AULA, CRIBS
Química Inorgânica. Folha de dicas: resumidamente, o mais importante
Diretório / Notas de aula, folhas de dicas Índice analítico
1. A relação entre os processos de metabolismo e energia no corpo. Sistema termodinâmico Os processos de vida na Terra são em grande parte devidos ao acúmulo de energia solar em substâncias biogênicas (proteínas, gorduras, carboidratos) e as transformações subsequentes dessas substâncias nos organismos vivos com a liberação de energia. Os trabalhos de A. M. Lavoisier (1743-1794) e P. S. Laplace (1749-1827) mostraram por meio de medidas calorimétricas diretas que a energia liberada durante a vida é determinada pela oxidação dos produtos alimentares pelo oxigênio do ar inalado pelos animais. Com o desenvolvimento nos séculos XIX-XX. termodinâmica, tornou-se possível calcular quantitativamente a conversão de energia em reações bioquímicas e prever sua direção. O método termodinâmico é baseado em vários conceitos estritos: "sistema", "estado do sistema", "energia interna do sistema", "função do estado do sistema". sistema termodinâmico qualquer objeto da natureza é chamado, consistindo em um número suficientemente grande de moléculas (unidades estruturais) e separado de outros objetos da natureza por uma superfície limite real ou imaginária (interface). Os objetos da natureza que não estão incluídos no sistema são chamados de ambiente. As características mais comuns dos sistemas são m - a massa da substância contida no sistema e E - a energia interna do sistema. A massa da substância do sistema é determinada pela massa total das moléculas que o compõem. A energia interna do sistema é a soma das energias do movimento térmico das moléculas e a energia de interação entre elas. Os sistemas de acordo com a natureza da troca de matéria e energia com o ambiente são divididos em três tipos: isolados, fechados e abertos. sistema isolado é chamado um sistema que não troca matéria ou energia com o meio (Δm = 0, ΔE = 0). Um sistema fechado é um sistema que não troca matéria com o ambiente, mas pode trocar energia (Δm = 0, ΔE^ 0). A troca de energia pode ser realizada transferindo calor ou realizando trabalho. sistema aberto tal sistema é chamado que pode trocar matéria e energia com o meio (Δm ≠ 0, ΔE ≠ 0). Um exemplo importante de um sistema aberto é a célula viva. Os sistemas, dependendo do estado de agregação da substância de que são compostos, são divididos em homogêneos e heterogêneos. Em um sistema homogêneo, não há mudanças bruscas nas propriedades físicas e químicas ao passar de uma área do sistema para outra. Um exemplo de tal sistema é o plasma sanguíneo, que é uma solução de várias substâncias biogênicas. Um sistema heterogêneo consiste em duas ou mais partes homogêneas. Um exemplo de sistema heterogêneo é o sangue total, ou seja, plasma com células - eritrócitos e leucócitos. 2. A primeira lei da termodinâmica. Conceitos que caracterizam o sistema A primeira lei da termodinâmica fornece uma estrutura quantitativa rigorosa para analisar a energia de vários sistemas. Para formulá-lo, é necessário introduzir uma série de novos conceitos que caracterizam o sistema. Um dos conceitos mais importantes é o estado do sistema. Um estado é entendido como um conjunto de propriedades do sistema que permitem definir um sistema do ponto de vista da termodinâmica. Como característica generalizada do estado do sistema, são utilizados os seguintes conceitos: "equilíbrio", "estacionário", "estado de transição". O estado do sistema é chamado de equilíbrio se todas as propriedades permanecerem constantes por qualquer grande período de tempo e não houver fluxos de matéria e energia no sistema. Se as propriedades do sistema são constantes no tempo, mas existem fluxos de matéria e energia, o estado é chamado de estacionário. Quantitativamente, os estados são distinguidos com a ajuda de variáveis termodinâmicas. Variáveis termodinâmicas são aquelas quantidades que caracterizam o estado do sistema como um todo. Eles também são chamados de parâmetros termodinâmicos do sistema. As variáveis termodinâmicas mais importantes são a pressão p, a temperatura T, o volume do sistema V ou a massa total do sistema m, as massas dos produtos químicos (componentes) mk que compõem o sistema, ou a concentração dessas substâncias m. Deve-se notar que características semelhantes (temperatura, peso, composição dos fluidos biológicos, pressão arterial) são usadas pelo médico para determinar a condição do paciente. A transição de um sistema de um estado para outro é chamada de o processo. Como resultado do processo, o estado do sistema e as variáveis termodinâmicas mudam. Se denotarmos o valor da variável termodinâmica no estado inicial como X1 , e finalmente - X2 , então a mudança nesta variável é respectivamente igual a ΔX = X2 - X1 e é chamado de incremento da variável termodinâmica X. O incremento, tomado com o sinal oposto, é chamado de diminuição da variável X. A energia interna do sistema E é uma das funções de estado termodinâmicas. Uma característica importante das funções de estado é sua independência do método de atingir um determinado estado do sistema. A mudança na energia interna do sistema ΔE é devido ao trabalho W, que é realizado durante a interação do sistema com o ambiente, e a troca de calor Q entre o ambiente e o sistema, a razão entre essas quantidades é a conteúdo da primeira lei da termodinâmica. O aumento da energia interna do sistema ΔE em algum processo é igual ao calor Q recebido pelo sistema, mais o trabalho W realizado sobre o sistema nesse processo: ∆E=Q+W. Em sistemas biológicos, o calor geralmente é liberado pelo sistema para o ambiente externo e o trabalho é realizado pelo sistema devido à perda de energia interna. É conveniente representar o registro matemático da primeira lei da termodinâmica na forma: ∆E = Q - W. Todas as quantidades nas fórmulas acima são medidas em joules (J). 3. Primeira lei da termodinâmica A primeira lei da termodinâmica é uma das leis fundamentais da natureza que não pode ser derivada de nenhuma outra lei. Sua validade é comprovada por numerosos experimentos, em particular, tentativas malsucedidas de construir uma máquina de movimento perpétuo do primeiro tipo, ou seja, uma máquina que poderia trabalhar por um tempo arbitrariamente longo sem fornecer energia de fora. Dependendo das condições do processo no sistema, várias funções de estado são usadas, derivadas da primeira lei da termodinâmica. Ao mesmo tempo, em vez de sistemas biológicos complexos, modelos simplificados são usados para obter conclusões sobre as transformações de massa e energia. A pressão no sistema é mantida constante, é igual à pressão externa. Tais processos que ocorrem em p = const são chamados isobáricos. O trabalho de expansão realizado em um processo isobárico é conhecido como: W =ρΔV, onde ΔV é o incremento de volume do sistema, igual à diferença entre os volumes nos estados 2 e 1. Substituindo o trabalho de expansão na expressão matemática da primeira lei e realizando transformações simples, obtemos: Qρ = ΔE + pΔV = (E2 +ρV2)-(E1 +ρΔV1) onde Qρ é o calor do processo isobárico; 1, 2 - índices relacionados ao início e fim do processo. O valor (E + pV) é uma função do estado do sistema, denotado por H e chamado de entalpia: H = E + ρV. Assim, a expressão pode ser escrita como: Qp = H2 - H1 = ∆H. Desta expressão segue que entalpia - função de estado, cujo incremento é igual ao calor recebido pelo sistema no processo isobárico. A medição do incremento de entalpia em um determinado processo pode ser realizada realizando este processo em um calorímetro a pressão constante. Foi assim que A. M. Lavoisier e P. S. Laplace realizaram seus experimentos, estudando a energética do metabolismo em um organismo vivo. Nos casos em que a mudança no estado do sistema ocorre a um volume constante, o processo é chamado de isocórico. Nesse caso, a variação de volume AV é igual a zero e, de acordo com a fórmula, o trabalho de expansão W = 0. Então, da expressão matemática da primeira lei da termodinâmica, segue: Qv = ∆E. A definição termodinâmica segue da relação acima: energia interna - função de estado, cujo incremento é igual ao calor QV obtido pelo sistema no processo isocórico. Portanto, a variação da energia interna em um determinado processo pode ser medida realizando esse processo em um calorímetro a volume constante. Segue-se que em ρ = const os incrementos de energia interna e entalpia estão relacionados pela relação: ∆H = ∆E + ρ∆V. 4. Lei de Hess A seção da termodinâmica que estuda a transformação de energia em reações químicas é chamada de termodinâmica química. A equação de reação para a qual as mudanças na energia interna ΔE, entalpia ΔH ou alguma outra função de estado correspondente a essa reação são indicadas é chamada termoquímica. Reações químicas durante as quais a entalpia do sistema diminui (ΔH < 0) e o calor é liberado para o ambiente externo são chamadas exotérmico. Reações nas quais a entalpia aumenta (ΔH > 0) e o sistema absorve calor Qp fora são chamados endotérmico. A oxidação da glicose com o oxigênio ocorre com a liberação de uma grande quantidade de calor (Qp \u2800d XNUMX kJ / / mol), ou seja, este processo é exotérmico. A equação termoquímica correspondente pode ser escrita como С6 Н12 О6 + 602 = 6С02 + 6N2Oh, ΔH = 2800 kJ. As reações que ocorrem em solução geralmente são acompanhadas por uma ligeira mudança no volume do sistema, ou seja, ΔV ≈ 0. Nesse sentido, em muitos casos, em cálculos biológicos, podemos supor que ΔH = ΔE. Consequentemente, a liberação de calor em tais sistemas se deve principalmente à diminuição da energia interna como resultado da reação e vice-versa. A entalpia de formação do composto A é a variação da entalpia do sistema ΔHA acompanhando a formação de 1 mol do composto A a partir de substâncias simples. As entalpias de formação de oxigênio, carbono, hidrogênio e todas as outras substâncias elementares (simples) são assumidas como zero. Outras coisas sendo iguais, a energia interna e a entalpia são proporcionais à quantidade de matéria no sistema. Tais funções termodinâmicas são chamadas extensivas. Do ponto de vista da termodinâmica, a reação da forma geral nAA + pВ = nС + nD , Δh é a transição do sistema do estado inicial com a entalpia H1 para o estado 2 com entalpia H2. A mudança na entalpia do sistema como resultado dessa transição, chamada de entalpia dessa reação, é igual à diferença: ΔHpya = H2 - H1 = (ncHc + nDHD) - (nАНА + nBHB). A lei da constância das somas de calor foi descoberta pelo químico russo G. I. Hess em 1840. Ele é o descobridor da aplicabilidade da primeira lei da termodinâmica em transformações químicas e o fundador da termodinâmica química. Atualmente, a lei de Hess é considerada como consequência da primeira lei da termodinâmica e é formulada da seguinte forma: o incremento de entalpia na formação de determinados produtos a partir de determinados reagentes a pressão constante não depende do número e tipo de reações que resultam na formação desses produtos. Nos cálculos termoquímicos, não é a própria lei de Hess que é mais utilizada, mas sua consequência, derivada acima para o caso particular da oxidação da glicose na forma de igualdade (2). Para uma reação apresentada na forma geral pАA + pвB = = nсC + nDD, uma consequência da lei de Hess é escrita usando a igualdade ΔHpya = (nCΔHC + nDΔHD) - (nAΔHA ++nBΔHB ) e é formulado da seguinte forma: a entalpia de reação é igual à soma algébrica das entalpias de formação de uma quantidade estequiométrica de produtos menos a soma algébrica das entalpias de formação de uma quantidade estequiométrica de reagentes. 5. A segunda lei da termodinâmica. Energia livre de Gibbs O corpo realiza trabalho gastando a energia interna armazenada na forma de energia da interação química dos átomos de suas substâncias constituintes. A expressão matemática ΔE \uXNUMXd Q - W da primeira lei da termodinâmica determina a relação exata entre o consumo de energia interna do sistema ΔЕ, o trabalho W realizado pelo sistema e a energia Q, que se perde na forma de calor. No entanto, a partir da primeira lei da termodinâmica é impossível determinar a parte da energia interna gasta que pode ser convertida em trabalho. As estimativas teóricas de custos são baseadas na segunda lei da termodinâmica. Esta lei impõe restrições estritas à eficiência de conversão de energia em trabalho e, além disso, permite introduzir critérios para a possibilidade de fluxo espontâneo de um processo. O processo é chamado espontâneose for realizado sem quaisquer influências, quando o sistema for entregue a si mesmo. Existem processos em que a energia interna do sistema não varia (ΔE = 0). Tais processos incluem, por exemplo, a ionização de ácido acético em água. Vários processos espontâneos prosseguem com um aumento na energia interna (ΔE > 0). Isso inclui, em particular, reações típicas de formação de compostos bioinorgânicos de albumina (proteína do plasma sanguíneo) com íons metálicos, como Cu2+. A variação da energia interna AE para sistemas fechados não pode servir de critério para processos espontâneos. Consequentemente, a primeira lei da termodinâmica, da qual este critério é derivado, não é suficiente para resolver a questão da espontaneidade, bem como a eficiência dos processos. A solução dessas questões é alcançada com a ajuda da segunda lei da termodinâmica. Para formular a segunda lei da termodinâmica, é necessário introduzir os conceitos de processos reversíveis e irreversíveis no sentido termodinâmico. Se o sistema está em equilíbrio, este estado é mantido indefinidamente enquanto as condições externas permanecem inalteradas. Quando as condições externas mudam, o estado do sistema pode mudar, ou seja, um processo pode ocorrer no sistema. Um processo é dito termodinamicamente reversível se, durante a transição do estado inicial 1 para o estado final 2, todos os estados intermediários estiverem em equilíbrio. O processo é chamado termodinamicamente irreversível se pelo menos um dos estados intermediários estiver fora de equilíbrio. Um processo reversível pode ser realizado apenas com uma mudança suficientemente lenta nos parâmetros do sistema - temperatura, pressão, concentração de substâncias, etc. A taxa de mudança nos parâmetros deve ser tal que os desvios do equilíbrio que ocorrem durante o processo sejam insignificantes. Deve-se notar que um problema importante na medicina está associado à reversibilidade - a preservação dos tecidos em baixas temperaturas. Os processos reversíveis são o caso limite dos processos reais ocorridos na natureza e realizados na indústria ou em laboratórios. 6. A segunda lei da termodinâmica. Entropia Trabalho máximo WMax, que pode ser obtido com uma dada perda de energia interna ΔE no processo de transição do estado 1 para o estado 2, só é alcançado se esse processo for reversível. De acordo com a expressão para a primeira lei da termodinâmica, o calor mínimo Qmin Qmin \uXNUMXd ΔE - WMax . O fator de eficiência máximo alcançável, que caracteriza a eficiência de custo da energia interna do sistema, é respectivamente igual a ηMax=WMax / ΔE. Em um processo irreversível de transição do estado 1 para o estado 2, o trabalho realizado pelo sistema é menor que W. Para calcular o fator máximo hMax com um valor conhecido de ΔE, é necessário conhecer o valor de WMax ou Qmin WMax = ΔE - Qmin , portanto, ηMax \u1d XNUMX - ΔE / Qmin . Valor Qmin pode ser calculado a partir da segunda lei da termodinâmica usando uma função de estado termodinâmica chamada entropia. O conceito de entropia foi introduzido (1865) pelo físico alemão R. Yu. Clausius (1822-1888), um dos fundadores da termodinâmica e da teoria cinética molecular dos processos térmicos. Definição termodinâmica de entropia de acordo com Clausius: entropia é uma função de estado cujo incremento ΔS é igual ao calor Qmin trazido para o sistema em um processo isotérmico reversível, dividido pela temperatura absoluta T na qual o processo é realizado: ∆S = Qmin /T. Segue da fórmula que a unidade de entropia é J/K. Um exemplo de um processo isotérmico reversível é o lento derretimento do gelo em uma garrafa térmica cheia de água a 273°K. Foi estabelecido experimentalmente que para a fusão de 1 mol de gelo (18 g) é necessário fornecer pelo menos 6000 J de calor. Neste caso, a entropia do sistema "gelo - água" na garrafa térmica aumenta em ΔS = 6000 J: 273°K = 22 J/K. Quando uma garrafa térmica com água é resfriada a 273°K, 6000 J de calor podem ser removidos lentamente e 1 mol de gelo é formado durante a cristalização da água. Para este processo, Qmin na fórmula é negativo. Consequentemente, a entropia do sistema "gelo - água" durante a formação de 1 mol de gelo diminui em ΔS = 22 J/K. Da mesma forma, é possível calcular a variação de entropia para quaisquer processos físicos e químicos isotérmicos, se o calor fornecido ao sistema ou removido dele durante esses processos for conhecido. Como é conhecido da física, esse calor pode ser determinado usando medidas calorimétricas. Assim, a variação na entropia, assim como em duas outras funções do estado do sistema - energia interna e entalpia, é uma quantidade determinada experimentalmente. O significado físico da entropia, assim como da energia interna, é claramente revelado quando se considera os processos que ocorrem em sistemas isolados do ponto de vista cinético-molecular. 7. Fórmula de Boltzmann Sistemas isolados, por definição, não trocam nem matéria nem energia com o meio ambiente. É claro que tais sistemas não existem realmente na natureza. No entanto, um isolamento muito bom pode ser obtido colocando o sistema em uma garrafa térmica vedada com uma rolha. Acontece que qualquer processo espontâneo pode ocorrer em um sistema isolado somente se for caracterizado por um aumento na entropia; em equilíbrio, a entropia do sistema é constante: ∆S ≥ 0. Esta afirmação, baseada em observações experimentais, é uma das possíveis formulações da segunda lei da termodinâmica. Um processo inverso ao espontâneo, de acordo com a segunda lei da termodinâmica, não pode ocorrer em um sistema isolado, pois tal processo é caracterizado por uma diminuição da entropia. Um exame de vários sistemas isolados mostra que processos espontâneos estão sempre associados a um aumento no número de microestados w do sistema. Nos mesmos processos, a entropia S do sistema aumenta, ou seja, a entropia aumenta com o aumento do número de microestados. Pela primeira vez, a existência de tal dependência foi notada pelo físico austríaco L. Boltzmann, que em 1872 propôs a relação: КБ =R/NA = 1,38 - 1023 J/K, onde KБ - Constante de Boltzmann, igual à razão entre a constante de gás R e a constante de Avogadro NA . Essa relação é chamada de fórmula de Boltzmann. A fórmula de Boltzmann permite calcular teoricamente a entropia de um sistema a partir do número de seus possíveis microestados. Tais cálculos estão em boa concordância com os valores determinados experimentalmente. Em particular, sabe-se que o número de microestados de substâncias cristalinas a 0°K é próximo de w0 "1. Assim, os valores absolutos da entropia das substâncias cristalizantes podem ser determinados, em contraste com a energia interna E e a entalpia H, para as quais apenas valores relativos podem ser determinados. Um aumento no número de microestados de um sistema em muitos casos pode estar associado a um aumento na desordem desse sistema, com uma transição para distribuições mais prováveis da energia do sistema. Com base na relação de Boltzmann, pode-se dar uma definição molecular-cinética de entropia. A entropia é uma medida da probabilidade de um sistema estar em um determinado estado ou uma medida da desordem do sistema. A importância do conceito de entropia se deve ao fato de que com base nesse valor é possível prever a direção dos processos espontâneos. No entanto, a aplicabilidade da medição da entropia como critério de direção de processos é limitada a sistemas isolados de acordo com a formulação da segunda lei da termodinâmica. 8. Energia de Gibbs Como critério para a espontaneidade dos processos em sistemas abertos e fechados, uma nova função de estado é introduzida - a energia de Gibbs. Essa função recebeu o nome do grande físico americano DW Gibbs (1839-1903), que derivou essa função e depois a usou no trabalho termodinâmico. A energia de Gibbs é determinada em termos da entalpia H e da entropia S usando as relações: G = H - S, ∆G = ∆H - ∆S. Com base na energia de Gibbs, a segunda lei da termodinâmica pode ser formulada da seguinte forma: sob condições isotérmicas isobáricas (p, T = const), apenas esses processos podem ocorrer espontaneamente no sistema, como resultado da diminuição da energia de Gibbs do sistema (ΔG <0). No estado de equilíbrio, a energia de Gibbs de o sistema não muda (G = const, AG = 0). ΔG < 0, p, T = const. Segue-se do exposto que a energia de Gibbs desempenha um papel importante no estudo dos processos bioenergéticos. Com esta função de estado, é possível prever a direção de processos espontâneos em sistemas biológicos e calcular a eficiência máxima alcançável. A energia de Gibbs G, como a entalpia H, é uma função do estado do sistema. Portanto, a mudança na energia de Gibbs ΔG pode ser usada para caracterizar transformações químicas de maneira semelhante à mudança na entalpia ΔH. As equações de reação para as quais a mudança na energia de Gibbs correspondente a essas reações é indicada também são chamadas de termoquímicas. As reações químicas, durante as quais a energia de Gibbs do sistema diminui (ΔG < 0) e o trabalho é realizado, são chamadas exergônicas. As reações, como resultado do aumento da energia de Gibbs (ΔG > 0) e do trabalho realizado no sistema, são chamadas endergônicas. Derivada da segunda lei da termodinâmica, a energia de Gibbs é uma função de estado. Portanto, assim como para a entalpia, a lei de Hess para a energia de Gibbs pode ser formulada da seguinte forma: a mudança na energia de Gibbs durante a formação de determinados produtos a partir de determinados reagentes a pressão e temperatura constantes não depende do número e tipo de reações que resultam na formação desses produtos. Um exemplo importante da aplicação da lei de Hess é o cálculo da energia de Gibbs da reação de oxidação da glicose com o dioxigênio. A mudança na energia de Gibbs nesta reação em p = 101 kPa e T = 298°K, determinada fora do corpo, é ΔG° = 2880 kJ/mol. A equação termoquímica correspondente é escrita como: С6Н12О6 + 6O2 = 6CO2 + 6N2Ah, ΔGpya° = 2880 kJ/mol. Nas células do corpo, essa reação é realizada através de várias etapas sucessivas estudadas por bioquímicos. Pode-se prever a partir da lei de Hess que a soma das mudanças de energia de Gibbs em todas as reações intermediárias é ΔGpya: ΔG1 +ΔG2 +ΔG3 + … + ∆Gn = ∆Gpya °. A energia de Gibbs de uma reação é igual à soma algébrica das energias de Gibbs de formação de uma quantidade estequiométrica de produtos menos a soma algébrica das energias de Gibbs de formação de uma quantidade estequiométrica de reagentes: ΔGpya = (ncΔGc + nDΔGD)(nAΔGA + nBΔGB). 9. Soluções. Classificação de soluções De acordo com o estado de agregação, as soluções podem ser gasosas, líquidas e sólidas. Qualquer solução consiste em solutos e um solvente, embora esses conceitos sejam um tanto arbitrários. Por exemplo, dependendo da proporção da quantidade de álcool e água, esse sistema pode ser uma solução de álcool em água ou água em álcool. Normalmente, o solvente é considerado o componente que está na solução no mesmo estado de agregação que antes da dissolução. A doutrina das soluções é de particular interesse para os médicos porque os fluidos biológicos mais importantes - sangue, linfa, urina, saliva, suor - são soluções de sais, proteínas, carboidratos, lipídios em água. Os fluidos biológicos estão envolvidos no transporte de nutrientes (gorduras, aminoácidos, oxigênio), drogas para órgãos e tecidos, bem como na excreção de metabólitos (ureia, bilirrubina, dióxido de carbono, etc.) do corpo. O plasma sanguíneo é um meio para células - linfócitos, eritrócitos, plaquetas. Nos meios líquidos do corpo, a constância da acidez, a concentração de sais e substâncias orgânicas é mantida. Essa constância é chamada de homeostase de concentração. Classificação de soluções Soluções de substâncias com massa molar inferior a 5000 g/mol são chamadas de soluções de compostos de baixo peso molecular (NMS), e soluções de substâncias com massa molar superior a 5000 g/mol são chamadas de soluções de compostos de alto peso molecular (HMC). De acordo com a presença ou ausência de dissociação eletrolítica, as soluções NMS são divididas em duas classes - soluções de eletrólitos e não eletrólitos. Soluções eletrolíticas - soluções de sais, ácidos, bases, anfólitos dissociando-se em íons. Por exemplo, soluções KNO3, HCl, KOH, Al(OH)3 , glicina. A condutividade elétrica das soluções eletrolíticas é maior do que a do solvente. Soluções de não eletrólitos - soluções de substâncias que praticamente não se dissociam em água. Por exemplo, soluções de sacarose, glicose, uréia. A condutividade elétrica de soluções não eletrolíticas difere pouco da de um solvente. Soluções de NMS (eletrólitos e não eletrólitos) são chamadas verdadeiras, em contraste com soluções coloidais. As soluções verdadeiras são caracterizadas por uma composição homogênea e pela ausência de uma interface entre o soluto e o solvente. O tamanho das partículas dissolvidas (íons e moléculas) é inferior a 109m A maioria dos DIUs são polímeros cujas moléculas (macromoléculas) consistem em um grande número de grupos repetitivos ou unidades monoméricas interligadas por ligações químicas. As soluções de DIU são chamadas de soluções de polieletrólitos. Polieletrólitos incluem poliácidos (heparina, ácido poliadenílico, ácido poliaspártico, etc.), polibases (polilisina), polianfólitos (proteínas, ácidos nucleicos). As propriedades das soluções HMS diferem significativamente das soluções NMS. Portanto, eles serão discutidos em uma seção separada. Este capítulo é dedicado a soluções de eletrólitos de baixo peso molecular, anfólitos e não eletrólitos. 10. Água como solvente O solvente mais comum em nosso planeta é a água. O corpo de uma pessoa média pesando 70 kg contém aproximadamente 40 kg de água. Ao mesmo tempo, cerca de 25 kg de água caem no líquido dentro das células e 15 kg é o líquido extracelular, que inclui plasma sanguíneo, líquido intercelular, líquido cefalorraquidiano, líquido intraocular e conteúdo líquido do trato gastrointestinal. Em organismos animais e vegetais, a água é geralmente superior a 50% e, em alguns casos, o teor de água atinge 90-95%. Devido às suas propriedades anômalas, a água é um solvente único, perfeitamente adaptado à vida. Em primeiro lugar, a água dissolve bem muitos compostos iônicos e polares. Esta propriedade da água é em grande parte devido à sua alta constante dielétrica (78,5). Outra grande classe de substâncias que são altamente solúveis em água inclui compostos orgânicos polares como açúcares, aldeídos, cetonas e álcoois. Sua solubilidade em água é explicada pela tendência das moléculas de água de formar ligações polares com os grupos funcionais polares dessas substâncias, por exemplo, com os grupos hidroxila de álcoois e açúcares ou com o átomo de oxigênio do grupo carbonila de aldeídos e cetonas. A seguir estão exemplos de ligações de hidrogênio importantes para a solubilidade de substâncias em sistemas biológicos. Devido à sua alta polaridade, a água provoca a hidrólise de substâncias. Como a água é a parte principal do ambiente interno do corpo, ela fornece os processos de absorção, movimentação de nutrientes e produtos metabólicos no corpo. Deve-se notar que a água é o produto final da oxidação biológica de substâncias, em particular a glicose. A formação de água como resultado desses processos é acompanhada pela liberação de uma grande quantidade de energia - aproximadamente 29 kJ / mol. Outras propriedades anômalas da água também são importantes: alta tensão superficial, baixa viscosidade, altos pontos de fusão e ebulição e uma densidade mais alta no estado líquido do que no estado sólido. A água é caracterizada pela presença de associados - grupos de moléculas conectadas por ligações de hidrogênio. Dependendo da afinidade pela água, os grupos funcionais das partículas dissolvidas são divididos em hidrofílicos (atraem água), facilmente solvatados pela água, hidrofóbicos (repelem a água) e anfifílicos. Grupos hidrofílicos incluem grupos funcionais polares: hidroxil -OH, amino -NH2 , tiol-SH, carboxil-COOH. Para grupos hidrofóbicos - não polares, por exemplo, radicais de hidrocarbonetos: CHXNUMX-(CH2)п -, A PARTIR DE6Н5 -. Os aminoácidos incluem substâncias (aminoácidos, proteínas) cujas moléculas contêm grupos hidrofílicos (-OH, -NH2 , -SH, -COOH) e grupos hidrofóbicos: (CH3 - (CH2)п ,-A PARTIR DE6Н5-). Quando substâncias anfifílicas são dissolvidas, a estrutura da água muda como resultado da interação com grupos hidrofóbicos. O grau de ordenação das moléculas de água próximas aos grupos hidrofóbicos aumenta e o contato das moléculas de água com os grupos hidrofóbicos é minimizado. Grupos hidrofóbicos, associando-se, empurram as moléculas de água para fora de sua área de localização. 11. A concentração da solução e como expressá-la Solução Um sistema homogêneo de composição variável de duas ou mais substâncias em estado de equilíbrio é chamado. As substâncias que compõem uma solução são chamadas de componentes da solução. Uma característica importante de uma solução é a sua concentração. Esse valor determina muitas propriedades da solução. Concentração de substância (componente da solução) é uma quantidade medida pela quantidade de um soluto contida em uma certa massa ou volume de uma solução ou solvente. As formas mais comumente usadas de expressar concentração são: fração de massa, concentração molar, concentração equivalente molar, fração molar, fração de volume, título. Fração de massa W(X) expresso em frações de uma unidade, porcentagem (%), ppm (um milésimo de um por cento) e em partes por milhão (ppm). A fração de massa é calculada pelas fórmulas: W(X) =m(X)/m(pp), W(X) =m(X)/m(pp) × 100%, onde m(X) - massa do componente X (soluto), kg (g); m (pp) é a massa da solução, kg (g). A concentração molar é expressa em mol/m3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. Na medicina, é preferível o uso de unidades de mol/l. A concentração molar é calculada pela fórmula: C(X) =n(X)/V(pp) =m(X)/M(X) ×V(rr), onde n(X) - quantidade da substância dissolvida do sistema, mol; M(X) é a massa molar do soluto, kg/mol ou g/mol; m(X) é a massa da substância dissolvida, respectivamente, kg ou g; V(rr) - volume de solução, l. concentração molar b(X) expresso em unidades de mol/kg. Formulário de registro, por exemplo: b (HCl) \u0,1d XNUMX mol / kg. Calcule a concentração molar pela fórmula: b(X) =n(X)/m(rl) =m(X)/M(X) ×m(rl) onde m(rl) - massa de solvente, kg. Em química, o conceito de equivalente e fator de equivalência é amplamente utilizado. Equivalente é chamada uma partícula real ou condicional da substância X, que em uma dada reação ácido-base é equivalente a um íon de hidrogênio, ou em uma dada reação redox - a um elétron, ou em uma dada reação de troca entre sais - a uma unidade de carga. Fração de volume f(X) expressa em frações de uma unidade ou em porcentagem, é calculada pela fórmula: Ф(X) = V(X)/V(rr) onde v(X) - o volume deste componente X da solução; V(rr) é o volume total do solvente. O título da solução é indicado por T(X), unidade de medida - kg/cm3 , g/cm3 , g/ml. O título da solução pode ser calculado pela fórmula: Т(X) =m(X)/V(rr) onde m(X) é a massa da substância, geralmente g; V(rr) volume de solução, ml. 12. Processo de dissolução A natureza do processo de dissolução é complexa. Naturalmente, surge a questão de por que algumas substâncias são facilmente solúveis em alguns solventes e pouco solúveis ou praticamente insolúveis em outros. A formação de soluções está sempre associada a determinados processos físicos. Um desses processos é a difusão de um soluto e um solvente. Devido à difusão, partículas (moléculas, íons) são removidas da superfície da substância dissolvida e são distribuídas uniformemente por todo o volume do solvente. É por isso que, na ausência de agitação, a taxa de dissolução depende da taxa de difusão. No entanto, é impossível explicar a solubilidade desigual de substâncias em vários solventes apenas por processos físicos. O grande químico russo D. I. Mendeleev (1834-1907) acreditava que os processos químicos desempenham um papel importante na dissolução. Ele provou a existência de hidratos de ácido sulfúrico H2TÃO4H2OH2TÃO42H2OH2TÃO44H2O e algumas outras substâncias, por exemplo, C2Н5OH3H2A. Nestes casos, a dissolução é acompanhada pela formação de ligações químicas entre as partículas do soluto e do solvente. Este processo é chamado de solvatação, no caso particular quando o solvente é a água, hidratação. Conforme estabelecido, dependendo da natureza do soluto, os solvatos (hidratos) podem ser formados como resultado de interações físicas: interação íon-dipolo (por exemplo, ao dissolver substâncias com estrutura iônica (NaCI, etc.); interação dipolo-dipolo - ao dissolver substâncias com estrutura molecular (substâncias orgânicas)). As interações químicas são realizadas devido às ligações doador-aceitador. Aqui, os íons soluto são aceptores de elétrons, e os solventes (Н2Ah, NH3) - doadores de elétrons (por exemplo, a formação de complexos aqua), bem como como resultado da formação de ligações de hidrogênio (por exemplo, a dissolução de álcool em água). A evidência da interação química de um soluto com um solvente é fornecida pelos efeitos térmicos e pela mudança de cor que acompanha a dissolução. Por exemplo, quando o hidróxido de potássio é dissolvido em água, o calor é liberado: KOH + xN2O \uXNUMXd KOH (N2Oh; ΔH°solução = 55 kJ/mol. E quando o cloreto de sódio é dissolvido, o calor é absorvido: NaCI + xH2O = NaCI(H2Oh; ΔH°solução = +3,8 kJ/mol. O calor liberado ou absorvido quando 1 mol de uma substância é dissolvido é chamado calor da solução Qsolução De acordo com a primeira lei da termodinâmica Qsolução = ΔHsolução, onde ΔHsolução é a variação de entalpia na dissolução de uma dada quantidade de uma substância. A dissolução do sulfato de cobre branco anidro em água leva ao aparecimento de uma cor azul intensa. A formação de solvatos, mudança de cor, efeitos térmicos, bem como vários outros fatores, indicam uma mudança na natureza química dos componentes da solução durante sua formação. Assim, de acordo com os conceitos modernos, a dissolução é um processo físico-químico no qual ambos os tipos de interação física e química desempenham um papel. 13. Termodinâmica do processo de dissolução De acordo com a segunda lei da termodinâmica, em p, T = const, as substâncias podem se dissolver espontaneamente em qualquer solvente se, como resultado desse processo, a energia de Gibbs do sistema diminuir, ou seja, ΔG = (ΔН - TΔS) < 0. O valor de ΔН é chamado de fator de entalpia, e o valor de TΔS é chamado de fator de entropia de dissolução. Quando substâncias líquidas e sólidas são dissolvidas, a entropia do sistema geralmente aumenta (ΔS > 0), pois as substâncias dissolvidas passam de um estado mais ordenado para um menos ordenado. A contribuição do fator de entropia, que contribui para o aumento da solubilidade, é especialmente perceptível em temperaturas elevadas, pois neste caso o fator T é grande e o valor absoluto do produto TΔS também é grande, respectivamente, a diminuição do Gibbs energia aumenta. Ao dissolver gases em um líquido, a entropia do sistema geralmente diminui (ΔS < 0), pois o soluto de um estado menos ordenado (grande volume) passa para um estado mais ordenado (pequeno volume). A diminuição da temperatura favorece a dissolução dos gases, pois neste caso o fator T é pequeno e o valor absoluto do produto TΔS será menor, e a diminuição da energia de Gibbs será maior, quanto menor o valor de T. Durante a formação de uma solução, a entalpia do sistema também pode aumentar (NaCl) e diminuir (KOH). A mudança na entalpia do processo de dissolução deve ser considerada de acordo com a lei de Hess como a soma algébrica das contribuições endo e exotérmicas de todos os processos que acompanham o processo de dissolução. Estes são os efeitos endotérmicos da destruição da rede cristalina das substâncias, a quebra das ligações das moléculas, a destruição da estrutura inicial do solvente e os efeitos exotérmicos da formação de vários produtos de interação, incluindo solvatos. Por simplicidade de apresentação, o incremento da entalpia de dissolução ΔНsolução pode ser representado como a diferença de energia Ecr, gasto na destruição da rede cristalina da substância dissolvida, e energia ESol, liberado durante a solvatação de partículas de soluto por moléculas de solvente. Em outras palavras, a variação de entalpia é a soma algébrica da variação de entalpia ΔHcr como resultado da destruição da rede cristalina e uma mudança na entalpia ΔНSol devido à solvatação por partículas de solvente: ΔNsolução = ΔHcr +ΔHSol, onde ΔHsolução - variação de entalpia durante a dissolução. No entanto, a dissolução de gases nobres em solventes orgânicos é frequentemente acompanhada pela absorção de calor, por exemplo, hélio e neônio em acetona, benzeno, etanol e ciclohexano. Ao dissolver sólidos com estrutura de cristal molecular e líquidos, as ligações moleculares não são muito fortes e, portanto, geralmente ΔHSol > ΔNcr Isso leva ao fato de que a dissolução de, por exemplo, álcoois e açúcares é um processo exotérmico (ΔНsolução <0). Ao dissolver sólidos com uma rede iônica, a razão de energia Ecr e ESol pode ser diferente. No entanto, na maioria dos casos, a energia liberada durante a solvatação dos íons não compensa a energia gasta na destruição da rede cristalina; portanto, o processo de dissolução é endotérmico. Assim, os dados termodinâmicos permitem prever a dissolução espontânea de várias substâncias com base na primeira e segunda leis da termodinâmica. 14. Solubilidade Se um soluto está em contato com um solvente, o processo de formação da solução em muitos casos ocorre espontaneamente até que uma certa concentração limite seja alcançada (ocorre a saturação). Isso acontece quando o equilíbrio é alcançado, quando os fatores de entalpia e entropia são iguais, ou seja, ΔН = TΔS. Por exemplo, quando os cristais são introduzidos em um líquido, moléculas ou íons passam da superfície do cristal para a solução. Devido à difusão, as partículas são distribuídas uniformemente por todo o volume do solvente. A dissolução prossegue para a saturação. Uma solução que contém a quantidade máxima de soluto a uma dada temperatura e está em equilíbrio com um excesso de soluto é chamada de saturada. Uma solução supersaturada é uma solução cuja concentração é maior que a de uma solução saturada. Uma solução com uma concentração menor do que uma solução saturada é chamada insaturada. A capacidade de uma substância se dissolver em um determinado solvente é chamada de solubilidade. Numericamente, a solubilidade de uma substância é igual à concentração de sua solução saturada. A solubilidade pode ser expressa nas mesmas unidades que a concentração, por exemplo, em termos da quantidade de soluto contida em 1 litro de uma solução saturada, mol/l, ou em termos da massa de um soluto em 100 g de uma solução saturada. . A unidade de solubilidade é gramas por 100 g de solvente. O valor correspondente é chamado de coeficiente de solubilidade. A solubilidade depende da natureza do soluto e do solvente, da temperatura, da pressão e da presença de outras substâncias na solução. Influência na solubilidade da natureza dos componentes A capacidade de dissolução das substâncias é determinada pela natureza das forças de interação entre as moléculas dos componentes da solução X1 eles2 : solvente - solvente (X1 - X1 ), soluto - soluto (X2 - X2 ), solvente - soluto (X1 - X2 ) (os pontos indicam ligação molecular). A solubilidade das substâncias varia muito. Os exemplos mostram a solubilidade de diferentes sais no mesmo solvente (água) e a solubilidade da mesma substância (AgNO3 ) em vários solventes. Substâncias com um tipo de ligação iônica e substâncias constituídas por moléculas polares se dissolvem melhor em solventes polares, como água, álcoois. Esses solventes são caracterizados por alta constante dielétrica. A alta solubilidade das substâncias é frequentemente devida à formação de ligações intermoleculares, em particular de hidrogênio. Assim, a solubilidade mútua ilimitada de água e álcool é explicada pela formação de ligações de hidrogênio entre moléculas de água e álcool, e a dissolução de cristais AgcI em uma solução aquosa de amônia é explicada pela formação de uma ligação química doadora-aceptora de um íon de prata com moléculas de amônia (AgCl é praticamente insolúvel em água). Pela mesma razão, a piridina, um solvente com baixa permissividade, apresenta uma solubilidade muito alta. Como a solubilidade caracteriza o verdadeiro equilíbrio, a influência das condições externas neste estado (pressão, temperatura) pode ser estimada qualitativamente usando o princípio de Le Chatelier. Tais avaliações são necessárias na prática de mergulho profundo, quando se trabalha em hot shops, etc. 15. Solubilidade de gases em líquidos. Leis de Henry-Dalton e Sechenov A dissolução de gases em líquidos é quase sempre acompanhada pela liberação de calor. Portanto, a solubilidade dos gases diminui com o aumento da temperatura de acordo com o princípio de Le Chatelier. Este padrão é frequentemente usado para remover gases dissolvidos da água (por exemplo, CO02) por fervura. Às vezes, a dissolução de um gás é acompanhada pela absorção de calor (por exemplo, a dissolução de gases nobres em alguns solventes orgânicos). Neste caso, o aumento da temperatura aumenta a solubilidade do gás. Um gás não se dissolve em um líquido indefinidamente. A uma certa concentração de gás X, um equilíbrio é estabelecido:  Quando um gás se dissolve em um líquido, ocorre uma diminuição significativa no volume do sistema. Portanto, um aumento de pressão, de acordo com o princípio de Le Chatelier, deve levar a um deslocamento do equilíbrio para a direita, ou seja, a um aumento na solubilidade do gás. Se o gás é ligeiramente solúvel em um determinado líquido e a pressão é baixa, então a solubilidade do gás é proporcional à sua pressão. Essa dependência é expressa pela lei de Henry (1803): a quantidade de gás dissolvida a uma dada temperatura em um certo volume de líquido em equilíbrio é diretamente proporcional à pressão do gás. A lei de Henry pode ser escrita da seguinte forma: с (X) =Kr(X) ×P(X) onde é a concentração de gás em uma solução saturada, mol/l; P(X) - pressão do gás X sobre a solução, Pa; Kr(X) - Constante de Henry para o gás X, mol × l1 × Pa1 . A constante de Henry depende da natureza do gás, solvente e temperatura. A lei de Henry é válida apenas para soluções relativamente diluídas, a baixas pressões e na ausência de interação química entre as moléculas do gás dissolvido e o solvente. A lei de Henry é um caso especial da lei geral de Dalton. Se estamos falando sobre a dissolução não de uma substância gasosa, mas de uma mistura de gases, a solubilidade de cada componente obedece à lei de Dalton: a solubilidade de cada um dos componentes da mistura gasosa a uma temperatura constante é proporcional à pressão parcial do componente acima do líquido e não depende da pressão total da mistura e da individualidade dos outros componentes. Em outras palavras, no caso da dissolução de uma mistura de gases em um líquido, a pressão parcial p! este componente. A pressão parcial de um componente é entendida como a proporção da pressão do componente da pressão total da mistura gasosa: Рi/Rgeral A pressão parcial do componente é calculada pela fórmula Estudando a solubilidade de gases em líquidos na presença de eletrólitos, o fisiologista russo I. M. Sechenov (1829-1905) estabeleceu o seguinte padrão (lei de Sechenov): a solubilidade de gases em líquidos na presença de eletrólitos diminui; gases são liberados. Рi = Pgeral ×(Xi) onde pi - pressão parcial do componente Xi; Рgeral pressão total da mistura gasosa; x(Xi) é a fração molar do componente i. Estudando a solubilidade de gases em líquidos na presença de eletrólitos, o fisiologista russo I. M. Sechenov (1829-1905) estabeleceu o seguinte padrão (lei de Sechenov): a solubilidade de gases em líquidos na presença de eletrólitos diminui; gases são liberados. 16. O papel da difusão nos processos de transferência de substâncias em sistemas biológicos A difusão desempenha um papel importante nos sistemas biológicos. Em primeiro lugar, o movimento de nutrientes e produtos metabólicos nos fluidos teciduais ocorre por difusão. Além disso, em muitos casos, a taxa de processos físico-químicos em organismos vivos é determinada pela taxa de difusão dos reagentes, uma vez que a difusão dos reagentes é geralmente a etapa mais lenta do processo, enquanto as reações bioquímicas envolvendo enzimas ocorrem muito rapidamente. Cada célula viva é cercada por uma membrana que serve para proteger e regular o ambiente intracelular. As substâncias passam através das membranas por dois mecanismos principais: por difusão ordinária (transporte passivo) e por transferência ativada energeticamente (transporte ativo). A camada interna da membrana consiste em cadeias de hidrocarbonetos. Portanto, muitas pequenas moléculas neutras e moléculas HMS não polares são solúveis nesta camada e podem passar através da membrana por difusão normal ao longo de um gradiente de concentração. Esse transporte de substâncias é chamado de passivo. A difusão desempenha um papel importante no processo de oxigenação do sangue nos pulmões. Devido à grande ramificação, a superfície dos alvéolos dos pulmões é grande (~ 80 m2), de modo que o oxigênio é dissolvido ativamente no plasma e entra nos eritrócitos. O sangue venoso está sem oxigênio - a concentração de oxigênio no sangue venoso tende a zero. Portanto, o gradiente de concentração de oxigênio entre a atmosfera e o sangue que entra nos pulmões é alto, resultando em captação ativa (de acordo com a lei de Fick). O movimento de substâncias de uma área de menor concentração para uma área de maior concentração contra um gradiente é chamado de transporte ativo. Tal processo não pode ocorrer espontaneamente e requer custos de energia. A fonte de energia é a reação de hidrólise exoergônica de um composto bioinorgânico - adenosina trifosfato (ATP). Uma distribuição estacionária estável das concentrações de íons K dentro e fora da célula é alcançada quando o fluxo de íons K através da membrana para dentro da célula se torna igual ao fluxo de íons K da célula devido à difusão passiva. A distribuição (homeostase iônica) é alcançada de forma semelhante para íons Na, apenas o transporte ativo e a difusão passiva compensadora de íons são direcionados opostamente aos fluxos correspondentes de íons K. O processo de difusão é amplamente utilizado na medicina. Por exemplo, o método de diálise baseado na seletividade de difusão de substâncias de baixo peso molecular através de uma membrana semipermeável ao longo de um gradiente de concentração é usado na prática clínica para criar um aparelho de "rim artificial". As partículas do DIU não passam por uma membrana semipermeável; portanto, os fluidos biológicos (por exemplo, plasma sanguíneo) podem ser purificados por diálise de substâncias nocivas de baixo peso molecular - "escórias" (ureia, ácido úrico, bilirrubina, aminas, excesso de íons K) que se acumulam em várias doenças. Durante a purificação, o sangue do paciente, retirado da veia, entra em câmaras especiais com membranas semipermeáveis, através das quais o SMN pode se difundir e ser removido do plasma. Em várias doenças inflamatórias, ocorre a destruição de proteínas e, no plasma sanguíneo, junto com a SNM, existem fragmentos de proteínas (peptídeos e polipeptídeos) que também precisam ser removidos. 17. Abaixando o ponto de congelamento e aumentando o ponto de ebulição das soluções Uma consequência direta da diminuição da pressão de vapor sobre a solução é uma mudança no ponto de congelamento ΔTз e ponto de ebulição das soluções ΔТк comparado com os valores dessas quantidades para um solvente puro. As relações entre essas quantidades também decorrem da segunda lei da termodinâmica. O ponto de ebulição de um líquido é a temperatura na qual sua pressão de vapor se torna igual à pressão externa (por exemplo, a 101,3 kPa, o ponto de ebulição da água é 100 ° C). O ponto de congelamento (cristalização) de um líquido é a temperatura na qual a pressão de vapor sobre o líquido é igual à pressão de vapor sobre a fase sólida. Se designarmos os pontos de congelamento e ebulição da solução T3 e Tk, e os mesmos valorespara o solvente T°3 e T°к , então obtemos: ΔTk = Tк - T°к > 0, ΔT3 = T°3 - T3 > 0. Os efeitos de aumentar o ponto de ebulição e diminuir o ponto de congelamento das soluções podem ser explicados qualitativamente usando o princípio de Le Chatelier. De fato, se em um sistema de equilíbrio "líquido - vapor" (por exemplo, H2Оg) - H2О(L)), introduza uma substância solúvel não volátil, então a pressão de vapor do solvente sobre a solução diminuirá. Para compensar a diminuição da pressão de vapor e atingir o estado de equilíbrio anterior, a solução deve ser aquecida a uma temperatura mais alta (mais de 373°K), pois o processo é endotérmico. Seja um sistema de equilíbrio "fase sólida - líquido", por exemplo H2Оt) > H2Оg), a 273°K. Se uma certa quantidade de uma substância não volátil (insolúvel na fase sólida) for dissolvida na fase líquida, a concentração de moléculas de água na fase líquida diminuirá. De acordo com o princípio de Le Chatelier, começará um processo para aumentar a quantidade de água na fase líquida - o derretimento do gelo. Para estabelecer um novo equilíbrio, a solução deve ser resfriada, ou seja, a temperatura deve ser diminuída, pois o processo é exotérmico. De acordo com a lei de Raoult para soluções diluídas, a diminuição da pressão de vapor é proporcional à concentração da solução. Portanto, o aumento do ponto de ebulição e a diminuição do ponto de congelamento de tais soluções devem aumentar com o aumento de sua concentração. Estudando o congelamento e ebulição de soluções, Raul encontrou: um aumento no ponto de ebulição ΔTк e abaixando o ponto de congelamento ΔT3 soluções diluídas de não eletrólitos é diretamente proporcional à concentração molar da solução: ΔTк =Kэb(X), ΔT3 = Kз b(X), onde b(X) - concentração molar, mol/kg; Кз e Kэ - coeficientes de proporcionalidade, kg × K × mol1 , que são chamadas de constantes ebuliométricas e criométricas, respectivamente. O significado físico das constantes Kэ e Kз fica claro se aceitarmos b(X) = 1. Então Kэ = ΔTк , e Kз = ΔTз . Em outras palavras, a constante ebuliométrica é numericamente igual ao aumento do ponto de ebulição de uma solução de um molar, e a constante criométrica é numericamente igual à diminuição do ponto de congelamento de uma solução de um molar. As constantes ebuliométricas e criométricas dependem apenas da natureza do solvente e não dependem da natureza do soluto (soluções ideais). 18. Pressão osmótica A osmose é a penetração predominantemente unilateral de moléculas de solvente (difusão) através de uma membrana semipermeável de um solvente para uma solução ou de uma solução com menor concentração para uma solução com maior concentração. Uma condição necessária para a ocorrência de osmose é a presença de um solvente e uma solução ou duas soluções de diferentes concentrações, separadas por uma membrana semipermeável. Do ponto de vista da termodinâmica, a força motriz da osmose é a tendência do sistema de equalizar as concentrações, pois nesse caso a entropia do sistema aumenta, pois o sistema passa para um estado menos ordenado, a energia de Gibbs do sistema diminui de acordo e os potenciais químicos são equalizados. Portanto, a osmose é um processo espontâneo. Um experimento simples pode servir como ilustração explicando a conexão entre o mecanismo de osmose e uma mudança na pressão de vapor sobre uma solução. Se um copo com um solvente puro e um copo com uma solução de alguma substância não volátil (os níveis de líquidos nos recipientes são os mesmos) são colocados em um recipiente de vidro fechado, depois de um tempo o nível do líquido no recipiente primeiro copo diminuirá e o nível da solução no segundo copo aumentará. Neste caso, o solvente passa do primeiro béquer para o segundo béquer, o que se deve (de acordo com a lei de Raoult) a uma pressão de vapor do solvente mais baixa sobre a solução do que sobre o solvente puro. Assim, o espaço de ar entre o solvente e a solução atua como uma membrana semipermeável. Vamos encher um recipiente de paredes semipermeáveis com uma solução aquosa de glicose e colocá-lo em outro recipiente com água para que os níveis dos líquidos nesses recipientes coincidam. Como resultado da osmose, o volume da solução no primeiro recipiente aumenta e o nível do líquido neste recipiente aumenta gradualmente. Isso cria uma pressão hidrostática adicional que impede a osmose. A pressão hidrostática da coluna líquida em equilíbrio osmótico determina a pressão osmótica da solução. Pressão osmótica chamado de valor medido pela pressão hidráulica mínima que deve ser aplicada à solução para interromper a osmose. Leis da pressão osmótica. Van't Hoff propôs uma equação empírica para calcular a pressão osmótica de soluções diluídas de não eletrólitos: π = C(X)rt, onde π - pressão osmótica, kPa; С(X) - concentração molar, mol/l; R é a constante universal do gás igual a 8,31 kPa - l/(mol - K); T é a temperatura absoluta, K. Embora a lei de van't Hoff tenha sido estabelecida com base em dados experimentais, ela pode ser derivada das condições de equilíbrio termodinâmico em ΔG = 0. Portanto, essa lei deve ser considerada como uma consequência da segunda lei da termodinâmica. A expressão na forma acima é semelhante à equação de Clapeyron-Mendeleev para gases ideais, no entanto, essas equações descrevem processos diferentes. 19. O papel da osmose e pressão osmótica em sistemas biológicos O fenômeno da osmose desempenha um papel importante em muitos sistemas químicos e biológicos. A osmose regula o fluxo de água para dentro das células e estruturas intercelulares. A elasticidade das células (turgor), que garante a elasticidade dos tecidos e a preservação de uma certa forma dos órgãos, é devido à pressão osmótica. As células animais e vegetais têm conchas ou uma camada superficial de protoplasma que possui as propriedades de membranas semipermeáveis. Quando essas células são colocadas em soluções com diferentes concentrações, observa-se a osmose. Soluções que têm a mesma pressão osmótica são chamadas de isotônicas. Se duas soluções têm pressão osmótica diferente, então a solução com alta pressão osmótica é hipertônica em relação à segunda e a segunda é hipotônica em relação à primeira. Quando as células são colocadas em uma solução isotônica, elas mantêm seu tamanho e funcionam normalmente. Quando as células são colocadas em uma solução hipotônica, a água de uma solução externa menos concentrada passa para as células, o que leva ao seu inchaço e, em seguida, à ruptura das membranas e à saída do conteúdo celular. Essa destruição das células é chamada de lise, no caso das hemácias esse processo é chamado de hemólise. O sangue com conteúdo celular saindo durante a hemólise é chamado de sangue de verniz por causa de sua cor. Quando as células são colocadas em uma solução hipertônica, a água sai das células em uma solução mais concentrada e observa-se o enrugamento (secagem) das células. Este fenômeno é chamado de plasmólise. Fluidos biológicos humanos (sangue, linfa, fluidos teciduais) são soluções aquosas de compostos de baixo peso molecular - NaCl, KCl, CaCl, compostos de alto peso molecular - proteínas, polissacarídeos, ácidos nucléicos e elementos formados - eritrócitos, leucócitos, plaquetas. Sua ação total determina a pressão osmótica dos fluidos biológicos. A pressão osmótica do sangue humano a 310°K (37°C) é de 780 kPa (7,7 atm). A mesma pressão é criada por uma solução aquosa de NaCl a 0,9% (0,15 mol/l), que é, portanto, isotônica com o sangue (solução salina). No entanto, além dos íons Na e C1, existem outros íons no sangue, além de DIUs e elementos figurados. Portanto, para fins médicos, é mais correto usar soluções que contenham os mesmos componentes e na mesma quantidade daquelas que compõem o sangue. Essas soluções são usadas como substitutos do sangue em cirurgia. O corpo humano, além da pressão osmótica, é caracterizado pela constância (homeostase) e outros indicadores físico-químicos do sangue, como a acidez. As flutuações permissíveis na pressão osmótica do sangue são muito pequenas e, mesmo em patologia grave, não excedem várias dezenas de kPa. Em vários procedimentos, apenas soluções isotônicas podem ser injetadas no sangue de humanos e animais em grandes quantidades. Com grandes perdas de sangue (por exemplo, após grandes operações, lesões), os pacientes recebem vários litros de solução isotônica para compensar a perda de líquido com sangue. O fenômeno da osmose é amplamente utilizado na prática médica. Assim, na cirurgia, são utilizados curativos hipertônicos (gaze embebida em solução hipertônica de NaCl 10%), que são injetados em feridas purulentas. De acordo com a lei da osmose, a corrente do fluido da ferida através da gaze é direcionada para fora, como resultado da limpeza constante da ferida de pus, microorganismos e produtos de decomposição. 20. Grau de dissociação (ionização). A força dos eletrólitos Eletrólitos que se dissociam quase completamente em íons (ionizam) são chamados de eletrólitos fortes, e eletrólitos que não são completamente ionizados são chamados de eletrólitos fracos. Em uma solução de eletrólitos fracos, juntamente com íons, existem moléculas não ionizadas. Foi por ionização incompleta que S. Arrhenius explicou porque o coeficiente isotônico de soluções de eletrólitos fracos não é igual a um inteiro. Para caracterizar quantitativamente a completude da dissociação, o conceito do grau de dissociação (ionização) é introduzido. O grau de dissociação (ionização) de um eletrólito é a razão entre o número de moléculas decompostas em íons e o número total de suas moléculas introduzidas na solução. Em outras palavras, an é a proporção de moléculas eletrolíticas decompostas em íons. O grau de dissociação é expresso como uma porcentagem ou frações de uma unidade: αн = Nн/ Np, onde N é o número de moléculas eletrolíticas decompostas em íons; Np o número de moléculas de eletrólito introduzidas na solução (dissolvidas). Então para C(CHXNUMXCOOH) = 0,1 mol/l, grau de dissociação αн = 0,013 (ou 1,3%). De acordo com o grau de dissociação, os eletrólitos são convencionalmente divididos em fortes (αн > 30%) e fraco (αн < 3%). No intervalo, os eletrólitos são considerados de força média. Quase todos os sais são considerados eletrólitos fortes. Dos ácidos e bases mais importantes, H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . Eletrólitos fracos incluem a maioria dos ácidos orgânicos, bem como alguns compostos inorgânicos - H2S, HCN, N2CO3 , ASSIM3 , HCl0, N2SOBRE3VO3 ,Hg2CI2 ,Fe(SCN)3 . An é determinado experimentalmente medindo-se o desvio das propriedades colativas de soluções eletrolíticas das dependências teóricas para soluções ideais. Por exemplo, o coeficiente isotônico i é determinado pelo método crioscópico, então o grau de dissociação é calculado.Para eletrólitos fortes, o grau de dissociação é aparente, pois eles se dissociam em íons quase completamente. O desvio do coeficiente isotônico i do conhecimento inteiro é explicado para eles não pela presença de moléculas não associadas na solução, mas por outros motivos. A dissociação é acompanhada pela liberação ou absorção de calor. Portanto, o grau de dissociação deve depender da temperatura. A influência da temperatura pode ser estimada de acordo com o princípio de Le Chatelier. Se a dissociação eletrolítica ocorre com a absorção de calor, então, com o aumento da temperatura, aumenta, se com a liberação de calor, diminui. O grau de dissociação eletrolítica é afetado pela concentração da solução. Quando a solução é diluída, o grau de dissociação aumenta significativamente. A este respeito, a classificação indicada da força dos eletrólitos de acordo com o grau de dissociação αн válido apenas para soluções com uma concentração de cerca de 0,1 mol/l. Se considerarmos a dissociação eletrolítica como um processo reversível em equilíbrio, então, de acordo com o princípio de Le Chatelier, a diluição com água aumenta o número de moléculas destiladas, ou seja, o grau de dissociação aumenta. O grau de dissociação de eletrólitos fracos também é afetado pela adição de íons de mesmo nome. Assim, a introdução de um eletrólito fraco no sistema de equilíbrio aumenta a concentração de íons, o que, de acordo com o princípio de Le Chatelier, leva a um deslocamento significativo do equilíbrio de dissociação para a esquerda, ou seja, uma diminuição no grau de dissociação . Assim, a adição de íons de mesmo nome a uma solução eletrolítica fraca reduz o grau de sua dissociação. 21. Constante de dissociação. Lei de reprodução de Ostwald. Teoria das soluções de eletrólitos fortes Quantitativamente, a dissociação eletrolítica como um processo reversível em equilíbrio pode ser caracterizada por uma constante de dissociação (ionização) determinada pela lei de ação das massas. A lei da ação das massas, estritamente falando, aplica-se a reações reversíveis, isto é, a soluções de eletrólitos fracos. Por exemplo, a dissociação do eletrólito KtnAnm pode ser representada como um processo de equilíbrio: Ktn Anm × nKtm+ +mAn . De acordo com a lei da ação das massas, a constante de equilíbrio é escrita da seguinte forma: КД = (Ktm+)n+(Umn)m + (KtnAnm) onde (Ktm+) e umn ) - concentrações de equilíbrio molar de íons eletrolíticos; (KtnAnm) é a concentração de equilíbrio molar de moléculas eletrolíticas não dissociadas; КД é a constante de equilíbrio, chamada de constante de dissociação. Esta equação é válida apenas para soluções diluídas de eletrólitos fracos. Ao aplicá-lo a soluções concentradas e a soluções de eletrólitos fortes, a equação deve ser modificada. Quanto maior a constante de dissociação KД , mais o eletrólito se dissocia. Em contraste com o grau de dissociação KД depende apenas da natureza do solvente, eletrólito e temperatura, mas não depende da concentração da solução. Assim, tanto a constante quanto o grau de dissociação eletrolítica são características quantitativas da dissociação. Naturalmente, há uma conexão entre eles. Os ácidos polibásicos e as bases poliácidas dissociam-se em etapas. Por exemplo, a dissociação do ácido fosfórico ocorre em três etapas:  Da mesma forma para bases poliácidas (por exemplo, Ca (OH)2) - a dissociação ocorre em duas etapas. A dissociação gradual é caracterizada pelo fato de que a decomposição do eletrólito em cada estágio subsequente ocorre em menor grau do que no anterior. Este caráter da mudança nas constantes de dissociação pode ser explicado pela atração eletrostática com base na lei de Coulomb. A energia de ionização é mínima quando um íon é separado de uma molécula de eletrólito neutro. O desprendimento de um íon a cada passo seguinte de dissociação requer energia crescente, uma vez que a remoção de um íon ocorre de uma partícula cuja carga se torna maior nos passos subsequentes. A dissociação quase completa de eletrólitos fortes em íons, independentemente da concentração de suas soluções, é confirmada por métodos de pesquisa físicos e físico-químicos. Assim, os valores do calor de neutralização de todos os ácidos fortes por bases fortes em soluções diluídas são quase os mesmos. Independentemente da natureza do ácido e da base, obtém-se o mesmo valor de AH = 56,5 kJ/mol. Este fato é uma prova clara da completa dissociação de soluções diluídas de ácidos e bases. Em todos os casos, o processo comum que ocorre durante a neutralização é a combinação de íons em uma molécula 22. Teoria dos ácidos e bases Muitos eletrólitos, em particular hidróxidos de vários elementos E, exibem as propriedades de ácidos ou bases. A dissociação do hidróxido EON pode ocorrer em dois tipos: 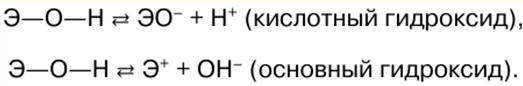 A lacuna pode ocorrer ao longo de ambas as ligações do grupo E-O-N. Como se sabe, a polaridade e a força das ligações dependem da diferença na eletronegatividade dos elementos, do tamanho e da carga efetiva dos átomos. Se a energia de quebra da ligação O-H for muito menor que a energia de quebra da ligação E-O, então a dissociação do hidróxido prossegue de acordo com o tipo de ácido. Se, pelo contrário, a energia de quebra da ligação O-H for muito maior do que a energia de quebra da ligação E-O, então a dissociação prossegue de acordo com o tipo principal. Em hidróxidos de metais alcalinos e alcalino-terrosos, bem como metais de transição em estados de baixa oxidação, a força da ligação E-O é relativamente baixa, o oxigênio é mais fortemente ligado ao hidrogênio e a dissociação E-O-H ocorre principalmente de acordo com o tipo básico, ou seja, com a eliminação de hidróxido diona. Isso se deve ao fato de que os íons de tais elementos são bastante grandes e têm uma pequena carga efetiva, ou seja, têm uma capacidade de polarização fraca. Com o aumento do grau de oxidação, o efeito polarizador do átomo E aumenta (aumento da carga específica), o oxigênio é mais firmemente ligado ao elemento E e a dissociação do E-O-H ocorre predominantemente de acordo com o tipo de ácido, ou seja, o íon hidrogênio é separado. Este último está relacionado com a redistribuição da densidade eletrônica no átomo de oxigênio. Como resultado, a ligação E-O torna-se mais forte e a ligação O-H torna-se mais fraca. Atualmente, não há uma definição inequívoca dos conceitos de ácido e base, que poderiam igualmente ser usados para caracterizar interações ácido-base em quaisquer solventes. Para caracterizar muitos eletrólitos em soluções aquosas, ainda é possível usar os conceitos de ácido e base dados por Arrhenius: 1) um ácido é um eletrólito que se dissocia em soluções para formar íons hidrogênio H; 2) a base é um eletrólito que se dissocia em soluções com a formação de íons hidróxido de OH; 3) anfólito (hidróxido anfótero) é um eletrólito que se dissocia em solução para formar íons de hidrogênio e íons de hidróxido. Anfólitos incluem hidróxidos de zinco, alumínio, cromo e outros elementos anfotéricos, bem como aminoácidos, proteínas, ácidos nucleicos. A aplicação do princípio de Le Chatelier à cadeia de equilíbrio ácido-base mostra que, com o aumento da concentração de íons hidróxido OH no sistema, a probabilidade de dissociação do tipo ácido aumenta. Um aumento na concentração de íons de hidrogênio H+ no sistema leva a dissociação predominante de acordo com o tipo principal. Isso significa que, em meio ácido, a anfólita apresenta caráter básico e, em meio alcalino, apresenta caráter ácido. Por exemplo, o hidróxido de zinco se comporta como uma base ao interagir com ácidos: Zn (OH)2 + 2HCI - ZnCl2 + 2N2SOBRE, e ao interagir com álcalis - como um ácido: Zn(OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. Sistemas tampão de sangue. Plasma sanguíneo Os sistemas tampão são de grande importância na manutenção do equilíbrio ácido-base dos organismos. Os fluidos intracelulares e extracelulares de todos os organismos vivos são caracterizados por um valor de pH constante, que é mantido com a ajuda de sistemas tampão. O valor de pH da maioria dos fluidos intracelulares está na faixa de 6,8 a 7,8. O equilíbrio ácido-base do equilíbrio de CO no sangue humano é fornecido por sistemas tampão de hidrogenocarbonato, fosfato e proteína. O valor normal de pH do plasma sanguíneo é de 7,40 ± 0 05. Isso corresponde à faixa de valores de acidez ativa de 3,7 a 4,0x108 mol/l. Uma vez que existem vários eletrólitos no sangue (HC03 , H2CO3 H2RO4 , NRO42 ), proteínas, aminoácidos, o que significa que eles se dissociam a tal ponto que a atividade de a (H +) está na faixa indicada. Devido ao fato de que o conteúdo de substâncias inorgânicas e orgânicas no plasma e nas células sanguíneas não é o mesmo, é aconselhável considerar esses componentes do sangue separadamente. plasma sanguíneo Sistema tampão HCO3 / N2CO3 é formado por ácido carbônico2CO3 e base conjugada HCO3 . É o sistema tampão mais importante no sangue. Um dos componentes é o ácido carbônico H2CO3 - formado pela interação do CO dissolvido no plasma2 com água: CO2(r) + N2Ele N2CO3. onde CO2(r) - concentração de CO dissolvido2 . A constante de equilíbrio desta reação é: K = [N2CO3] / [CO2] Entre SO2 nos alvéolos e no tampão de carbonato de hidrogênio no plasma sanguíneo que flui pelos capilares dos pulmões, uma cadeia de equilíbrio é estabelecida. O sistema tampão de hidrogenocarbonato atua como um tampão fisiológico eficaz próximo ao pH 7,4. Após a entrada no sangue de ácidos - doadores de H+ o equilíbrio na cadeia de acordo com o princípio de Le Chatelier se desloca para a esquerda como resultado do fato de que os íons HCO3 ligar íons H em moléculas de H2CO3 . Ao mesmo tempo, a concentração de H2CO3 aumenta, e a concentração de íons HCO3 vai para baixo. Aumentando a concentração de H2CO3 leva a um deslocamento do equilíbrio para a esquerda (princípio de Le Chatelier). Causa apodrecimento2CO3 e um aumento na concentração de CO2 dissolvido no plasma. Como resultado, o equilíbrio se desloca para a esquerda e a pressão do CO aumenta.2 nos pulmões. Excesso de CO2 excretado do corpo. Como resultado, o sistema de carbonato de hidrogênio do sangue rapidamente entra em equilíbrio com o CO2 nos alvéolos e efetivamente mantém a constância do pH do plasma sanguíneo. 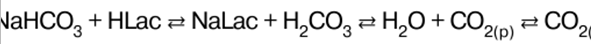 Assim, um valor de pH sanguíneo normal é mantido com uma mudança de pH ligeiramente pronunciada devido à acidose. Em espaços fechados, muitas vezes experimentam asfixia (falta de oxigênio), aumento da respiração. No entanto, a asfixia está associada não tanto à falta de oxigênio quanto ao excesso de CO2. Excesso de CO2 na atmosfera, de acordo com a lei de Henry, leva à dissolução adicional de CO2 em sangue. E isso leva a uma diminuição do pH do sangue, ou seja, à acidose. O sistema tampão de carbonato de hidrogênio responde mais rapidamente às mudanças no pH do sangue. Sua capacidade de tampão ácido é Vк \u40d XNUMX mmol / l de plasma sanguíneo, e a capacidade tampão para álcali é muito menor e é aproximadamente igual a Vщ = 1-2 mmol/l de plasma sanguíneo. 24. Reações de neutralização As reações de neutralização são chamadas de reações de troca da interação de ácidos e bases, como resultado da formação de sal e água. Considere diferentes tipos de reações de neutralização. 1. Neutralização de uma base forte com um ácido forte: KOH + HNO3 - CONHEÇA3 + N2O. A equação iônica molecular para tal reação H+ + OH → N2O e o valor negativo da energia de Gibbs ΔG° mostram que o equilíbrio é praticamente deslocado para a formação de água. Um caso comum de reação de neutralização é a interação de ácidos e bases que diferem em força (o grau de dissociação). Essas reações não são completadas devido à reação reversa da hidrólise do sal. 2. Neutralização de um ácido fraco com uma base forte:  ou na forma molecular:  Neste caso, a reação de neutralização é reversível. A reação de neutralizar uma base fraca com um ácido forte também é reversível:  ou na forma molecular: 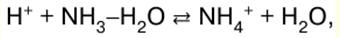 e também - uma base fraca com um ácido fraco: 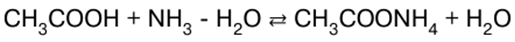 ou na forma molecular:  Nesses sistemas, o equilíbrio é fortemente deslocado para a direita, uma vez que a água é um eletrólito muito mais fraco que o ácido cianídrico, amônia e ácido acético. As reações de neutralização formam a base do método de neutralização. Este método é usado em laboratórios clínicos para determinar a acidez do suco gástrico, a capacidade tampão do plasma sanguíneo. Em farmacologia, é utilizado para a análise quantitativa de ácidos inorgânicos (clorídrico, sulfúrico, bórico) e ácidos orgânicos (acético, benzóico, tartárico, cítrico, salicílico). Em estudos biofarmacêuticos, o pKa dos ácidos e o pKa das bases são determinados pelo método de neutralização, pois o valor desses valores pode prever a capacidade dos medicamentos de passar pelas membranas biológicas. A titulação ácido-base é usada para determinar pKа aminoácidos e pKа dissociando grupos em proteínas. As curvas de titulação de proteínas obtidas em duas temperaturas diferentes podem ser usadas para determinar o número de grupos carboxila, imidazol e outros. A titulação de aminoácidos e proteínas permite determinar seus pontos isoelétricos. A hidrólise é a decomposição de uma substância pela água. Compostos químicos de várias classes podem sofrer hidrólise: proteínas, gorduras, carboidratos, ésteres, sais, etc. Na química inorgânica, eles são mais frequentemente encontrados com a hidrólise de sais. 25. Hidrólise de sal Hidrólise de sal - esta é a interação do sal com as moléculas de água, levando à formação de compostos de baixa dissociação. O processo de hidrólise consiste na transição de um próton de uma molécula de água para um determinado íon (CO32 + HOH * HCO3+ OH ) ou de um determinado íon, inclusive de um cátion metálico hidratado, para uma molécula de água. Dependendo da natureza do sal, a água atua como ácido ou como base, e o sal é, respectivamente, a base conjugada ou o ácido conjugado. Quatro variantes de hidrólise são possíveis dependendo do tipo de sal. 1. Sais formados por um ácido forte e uma base fraca:  2. Sais formados por uma base forte e um ácido fraco: CH3COONa + HOH → CH3COOH + NaOH. 3. Sais formados por um ácido fraco e uma base fraca. O cianeto de amônio é hidrolisado pela reação: 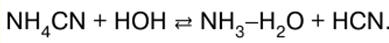 4. Sais formados por um ácido forte e uma base forte. NaCl, KNO3 não sofrem hidrólise. O mecanismo de hidrólise do sal consiste na interação de polarização dos íons do sal com sua camada de hidratação. Quanto mais forte essa interação, mais intensa será a hidrólise. Todos os casos considerados de hidrólise diziam respeito a sais formados por bases mono-ácidas e ácidos mono-básicos. Sais de ácidos polibásicos e bases poliácidas são hidrolisados passo a passo, formando sais ácidos e básicos. Quantitativamente, a hidrólise como equilíbrio de CO é caracterizada pelo grau de hidrólise e pela constante de hidrólise. O grau de hidrólise é medido pela razão entre a quantidade de substância hidrolisada e a quantidade total de soluto. O grau de hidrólise depende da natureza do sal, sua concentração e temperatura. De acordo com a lei da ação das massas, o grau de hidrólise aumenta com a diluição da solução. Então, em uma concentração Na2CO3 0,001 mol/l, o grau de hidrólise é de 34%. No caso geral, as seguintes regularidades são verdadeiras. 1. A hidrólise do sal deve aumentar com o aumento da temperatura e diluição da solução. 2. Na hidrólise reversível, de acordo com o princípio de Le Chatelier, o processo deve ser suprimido por acidificação (se este sal for formado por um ácido forte e uma base fraca, os íons H se acumulam) ou por alcalinização (se o sal for formado por um ácido fraco e uma base forte, os íons OH se acumulam). 3. A hidrólise de sais, que resulta na formação de produtos pouco solúveis ou gasosos que são removidos da esfera de reação (princípio do deslocamento do equilíbrio), é irreversível. Por exemplo, hidrólise de Pb(SO4)2 procede inteiramente devido à formação de um precipitado de PbO2: Pb(TÃO4)2 + 2N2O→PbO2 + 2H2SO4. A hidrólise é característica de muitas classes de compostos inorgânicos e orgânicos. A hidrólise de compostos inorgânicos é importante para avaliar sua toxicidade. A hidrólise de compostos orgânicos é usada para obter produtos valiosos de madeira, gorduras, ésteres e outras coisas, mas a hidrólise desempenha um papel particularmente importante na vida dos organismos vivos. 26. Precipitação e reação de dissolução As reações de troca que ocorrem na solução eletrolítica incluem as reações de precipitação e dissolução. As reações de precipitação são acompanhadas por precipitação. As reações acompanhadas pela dissolução de precipitados são chamadas de reações de dissolução. Sistemas que consistem em um depósito de um eletrólito pouco solúvel e uma solução saturada acima dele são amplamente utilizados. Em tais sistemas, um equilíbrio dinâmico é estabelecido entre a solução saturada e o precipitado. Devido à baixa solubilidade, a concentração do eletrólito pouco solúvel na solução é muito baixa; portanto, pode-se considerar que está completamente dissociado na solução. Em outras palavras, o equilíbrio dinâmico em uma solução saturada é estabelecido entre a fase sólida da substância e os íons que passaram para a solução. Por exemplo, em uma solução saturada de AgCl, ocorre o seguinte equilíbrio: AgCl(T) → Ag+(P) + Cl(R). A concentração da fase sólida AgCl como um valor constante é excluída da expressão para a constante de equilíbrio. Como resultado, a constante de equilíbrio é determinada apenas pelo produto das concentrações de íons na solução e é chamada de constante ou produto de solubilidade. No caso geral, para o eletrólito Ktn Anm, a constante de solubilidade é determinada pelo produto estequiométrico das concentrações de íons: Кetc.= [Ktm+ ]n[Umn]m Este valor caracteriza a solubilidade do eletrólito a uma temperatura constante na ausência de substâncias estranhas. Constância Ketc. não significa a constância das concentrações de íons individuais em solução. Assim, é possível aumentar a concentração de íons Ag em uma solução saturada de AgCl adicionando, por exemplo, AgNO3 , enquanto o equilíbrio de acordo com o princípio de Le Chatelier se deslocará para a esquerda, o que levará a um aumento na taxa de deposição de íons. Após algum tempo, as taxas de dissolução de AgCl e a precipitação de íons Ag e Cl se tornarão iguais. O equilíbrio recém-estabelecido será, como antes, caracterizado pelo valor Ketc.(AgCl), mas as concentrações de equilíbrio dos íons Ag e Cl mudarão. Assim, com base em Ketc. é possível prever a formação e dissolução de precipitados eletrolíticos com base em duas regras. 1. Um eletrólito precipita quando o produto estequiométrico das concentrações de seus íons em solução é maior que a constante de solubilidade. 2. O precipitado eletrolítico se dissolve quando o produto estequiométrico das concentrações de seus íons constituintes em solução torna-se menor que a constante de solubilidade. As reações de precipitação formam a base do método de precipitação usado na análise quantitativa de produtos farmacêuticos. O método de precipitação é utilizado na análise clínica de cloretos na urina, suco gástrico, sangue, na prática sanitária e higiênica - na análise da água potável. Os cientistas acreditam que a diferente solubilidade dos compostos naturais dos elementos na água teve uma grande influência em seu conteúdo nos organismos vivos. Existe uma estreita relação entre a solubilidade de compostos em água e o efeito tóxico de íons de vários elementos. Por exemplo, a introdução de Al3 + no corpo devido à formação de fosfato de alumínio pouco solúvel AlPO4 27. Reações redox Um dos conceitos básicos da química inorgânica é o conceito de estado de oxidação (CO). O estado de oxidação de um elemento em um composto é a carga formal do átomo do elemento, calculada a partir da suposição de que os elétrons de valência passam para átomos com maior eletronegatividade relativa (RER) e todas as ligações na molécula do composto são iônicas. O estado de oxidação do elemento E é indicado na parte superior acima do símbolo do elemento com um sinal "+" ou "-" antes do número. O grau de oxidação dos íons que realmente existem em uma solução ou cristais coincide com seu número de carga e é indicado de forma semelhante com o sinal "+" ou "-" após o número, por exemplo, Cl,Ca2+. O método Stock também é usado para indicar o grau de oxidação em algarismos romanos após o símbolo do elemento: Mn (VII), Fe (III). A questão do sinal do estado de oxidação dos átomos em uma molécula é resolvida com base na comparação das eletronegatividades dos átomos interligados que formam a molécula. Nesse caso, um átomo com menor eletronegatividade tem um estado de oxidação positivo e com maior eletronegatividade - negativo. Deve-se notar que o estado de oxidação não pode ser identificado com a valência do elemento. A valência, definida como o número de ligações químicas pelas quais um determinado átomo está ligado a outros átomos, não pode ser zero e não possui sinal "+" ou "-". O estado de oxidação pode ter valores positivos e negativos, bem como valores zero e até mesmo fracionários. Por exemplo, em uma molécula de CO2 o estado de oxidação de C é +4, e na molécula de CH4 o estado de oxidação de C é 4. A valência do carbono4a em ambos os compostos é IV. Apesar das desvantagens acima, o uso do conceito de grau de oxidação é conveniente na classificação de compostos químicos e na formulação de equações para reações redox. Quando um elemento é oxidado, o estado de oxidação aumenta, ou seja, o agente redutor durante a reação aumenta o estado de oxidação. Ao contrário, quando o elemento é reduzido, o estado de oxidação diminui, ou seja, durante a reação, o agente oxidante reduz o estado de oxidação. Assim, é possível dar a seguinte formulação de reações redox: reações redox são reações que ocorrem com uma mudança no estado de oxidação dos átomos dos elementos que compõem as substâncias reagentes. 28. Agentes oxidantes e redutores Para prever os produtos e a direção das reações redox, é útil lembrar que os agentes oxidantes típicos são substâncias simples cujos átomos têm um EER> 3,0 grande (elementos dos grupos VIA e VIIA). Destes, os oxidantes mais poderosos são flúor (OEO = 4,0), oxigênio (OEO = 3,0), cloro (OEO = 3,5). Oxidantes importantes incluem PbO2 , KMnO4 , Ca(SO4)2 , PARA2Cr2O7 , HClO, HClO3, KSIO4, NaBio3, H2SO4(fim), H.N.O.3 (fim) , N / D2O2 , (NH4)2S2O8 , KSIO3 , H2O2 e outras substâncias que contêm átomos de CO mais altos ou mais altos. Os agentes redutores típicos incluem substâncias simples cujos átomos têm um EER pequeno < 1,5 (metais dos grupos IA e IIA e alguns outros metais). Agentes redutores importantes incluem H2S, N. H.3, OI, KI, SnCl2 , FeSO4 , CH2 ,CO,H2SO3 , cr2(SO4)3 , CuCl, Na2S2O3 e outras substâncias que contêm átomos de CO baixo. Substâncias contendo átomos nos estados de oxidação máximo e mínimo, respectivamente, só podem ser agentes oxidantes, por exemplo, K2SG2O7 , KMPO4 , PbO2 , HClO4 ou apenas agentes redutores, como NH3 , H2S, OI. Substâncias contendo átomos em estados de oxidação intermediários são capazes de aumentar e diminuir o estado de oxidação, ou seja, podem ser tanto agentes redutores (sob a ação de um agente oxidante mais ativo que eles) quanto agentes oxidantes (sob a ação de um agente oxidante mais ativo). do que eles, agente redutor). Tais substâncias exibem dualidade redox. Ao compilar as equações de reações redox, dois métodos podem ser usados: o método de balanço de elétrons e o método de íon-elétron (método de meia-reação). Uma ideia mais correta dos processos redox em soluções é dada pelo método íon-elétron. Com a ajuda deste método, prevê-se as mudanças que sofrem os íons e as moléculas realmente existentes em uma solução. Além de prever os produtos da reação, as equações de meia-reação iônica são necessárias para entender os processos redox que ocorrem durante a eletrólise e nas células galvânicas. Esse método reflete o papel do ambiente como participante do processo. E, finalmente, ao usar esse método, não é necessário conhecer antecipadamente todas as substâncias formadas, pois muitas delas são obtidas compilando a equação das reações redox. Deve-se ter em mente que, embora as semi-reações reflitam os processos reais que ocorrem durante as reações redox, elas não podem ser identificadas com os estágios reais (mecanismo) das reações redox. Muitos fatores influenciam a natureza e direção das reações redox: a natureza dos reagentes, a reação do meio, concentração, temperatura e catalisadores. Deve-se ter em mente que um valor negativo nem sempre leva a uma decisão inequívoca sobre o curso real da reação em uma determinada direção, pois é necessário levar em consideração adicionalmente o fator cinético. 29. Significado biológico dos processos redox As reações redox são processos químicos acompanhados pela transferência de elétrons de uma molécula ou íon para outra. Nas reações redox, ocorrem dois processos inter-relacionados: oxidação e redução. A oxidação é o processo de perda de elétrons. A recuperação é o processo de adição de elétrons. As substâncias cujos átomos ou íons doam elétrons são chamadas de agentes redutores. As substâncias cujos átomos ou íons adicionam elétrons (ou puxam um par comum de elétrons para si) são chamadas de agentes oxidantes. Na reação do zinco com CuSO4 Cu2 + adicionar elétrons: Si2+ + 2e־ - Sim0 . Os átomos de zinco doam elétrons: Zn0 -Zn2 + 2e־. Assim, CuSO4 - agente oxidante, Zn - agente redutor. Processos importantes em organismos animais são as reações de oxidação enzimática de substâncias substrato: carboidratos, gorduras, aminoácidos. Como resultado desses processos, os organismos recebem uma grande quantidade de energia. Aproximadamente 90% da necessidade total de energia de um homem adulto é coberta pela energia produzida nos tecidos durante a oxidação de carboidratos e gorduras. O restante da energia - ~10% é fornecido pela quebra oxidativa de aminoácidos. A oxidação biológica ocorre através de mecanismos complexos com a participação de um grande número de enzimas. Nas mitocôndrias, a oxidação ocorre como resultado da transferência de elétrons de substratos orgânicos. Como transportadores de elétrons, a cadeia respiratória das mitocôndrias inclui várias proteínas contendo vários grupos funcionais que são projetados para transportar elétrons. À medida que se movem ao longo da cadeia de um intermediário para outro, os elétrons perdem sua energia livre. Para cada par de elétrons transferidos através da cadeia respiratória para o oxigênio, 3 moléculas de ATP são sintetizadas. A energia livre liberada durante a transferência de 2 elétrons para o oxigênio é 220 kJ/mol. A síntese de 1 molécula de ATP em condições padrão consome 30,5 kJ. A partir disso, fica claro que uma parte bastante significativa da energia livre liberada durante a transferência de um par de elétrons é armazenada nas moléculas de ATP. A partir desses dados, o papel da transferência de elétrons em vários estágios do agente redutor inicial para o oxigênio também fica claro. A grande energia (220 kJ) liberada durante a transferência de um par de elétrons para o oxigênio é dividida em várias porções correspondentes aos estágios individuais de oxidação. Em três desses estágios, a quantidade de energia liberada corresponde aproximadamente à energia necessária para a síntese de 1 molécula de ATP. As reações redox fundamentam os métodos de oxidimetria, que são usados em análises clínicas para determinar íons Ca, ácido úrico, enzimas catalase e peroxidase, açúcar no sangue e em análises sanitárias e higiênicas para determinar a oxidabilidade da água, o teor de cloro ativo no alvejante, cloro residual na água doméstica e potável 30. Ligação química e suas características experimentais O desenvolvimento de um modelo moderno do átomo e a previsão das propriedades de átomos individuais com base nele é uma conquista muito importante da mecânica quântica. No entanto, átomos isolados raramente são encontrados em condições terrestres. Os corpos da natureza inanimada e viva ao nosso redor consistem em uma variedade de moléculas. A. M. Butlerov (1828-1886) criou a teoria da estrutura química das substâncias orgânicas (1861). Desde aquela época, os conceitos de "valência" e "ligação química" gradualmente começaram a entrar na química. Valência é a capacidade de um átomo de ligar um certo número de outros átomos para formar uma molécula. A valência é indicada por traços ao lado do símbolo do elemento. O hidrogênio (H) é monovalente, o oxigênio (0= ) é bivalente. O número de linhas de valência determina o número de ligações químicas que um determinado átomo pode formar com outros átomos. Uma ligação química é um conjunto de interações entre elétrons e núcleos, levando à combinação de átomos em uma molécula. As propriedades de uma ligação química são estudadas por vários métodos. Com a ajuda de métodos químicos, o número de ligações dos átomos (valência) e sua reatividade são determinados. Usando métodos físicos, o comprimento, força, orientação e polaridade das ligações químicas são determinados. Comprimento da ligação química rс chamado de valor medido pela distância entre os núcleos dos átomos ligados. Como uma unidade de comprimento de ligação química gс conveniente de usar picômetro (pm): 1 pm = 1012 m Força de ligação química Eс - valor medido pela entalpia ΔЕс formação de conexão. Como uma unidade de força de ligação química Eс kJ/mol é usado. Orientação da ligação química aс - um valor medido pelo ângulo entre as direções das ligações de um determinado átomo com os átomos vizinhos da molécula. O ângulo ac é chamado de ângulo de valência. Unidade de ângulo de ligação aс - grau. Polaridade da ligação química μс - o valor medido pelo momento elétrico desta ligação. O momento elétrico para duas cargas elétricas +q e ־q, iguais em valor absoluto e opostos em sinal, é igual a μ = qr, onde r é a distância entre as cargas. Essas duas cargas formam um dipolo elétrico. Uma ligação química polariza quando 2 átomos com eletronegatividade diferente (EEO) se ligam. Como resultado, um excesso de carga negativa δ surge em um átomo com um grande EER, e um excesso de carga positiva +δ surge em outro átomo com um EER menor. A polaridade da ligação é calculada pela fórmula: μс = δrс. Como unidade para medir a polaridade de uma ligação química, é conveniente usar a unidade Debye fora do sistema (D) - 1 D = 3,3 x 1030 C/m. A polaridade da ligação O-H na molécula de água é μele = 1,5D. O estudo da ligação química mostrou que na maioria dos casos o comprimento, força, orientação, polaridade da mesma ligação química em diferentes compostos têm aproximadamente os mesmos valores. Portanto, segue-se que as interações que levam à formação de uma determinada ligação entre átomos são da mesma natureza em moléculas diferentes. As teorias da mecânica quântica de ligações químicas fornecem uma explicação para esse fato. 31. Ligação de hidrogênio. Ligação de hidrogênio intermolecular e intramolecular As ligações químicas nas moléculas são geralmente muito fortes, sua energia está na faixa de 100-150 kJ/mol. Além disso, existem as chamadas ligações de hidrogênio, cuja força é de 10-40 kJ/mol. A duração dessas ligações é 270-230 pm, respectivamente. Ligação de hidrogênio entre os átomos EА e EВ chamada de interação realizada por um átomo de hidrogênio conectado a EА ou EВ ligação química. A imagem de uma ligação de hidrogênio no caso geral tem a forma: ЭА-N...Eв.. Obviamente, a ligação de hidrogênio é de três centros, já que 3 átomos participam de sua formação. Para a ocorrência de tal ligação, é necessário que os átomos EА e EВ possuem alta eletronegatividade. Estes são os átomos dos elementos mais negativos: nitrogênio (REO = 3,0), oxigênio (REO = 3,5), flúor (REO = 4,0) e cloro (REO = 3,0). Uma ligação de hidrogênio é formada como resultado de uma combinação de hidrogênio ls-AO e dois átomos 2pAO EА e EВ; 2rorbitais são orientados ao longo de uma linha reta. Portanto, a ligação de hidrogênio é linear. A ligação de hidrogênio é chamada de: 1) intramolecular, se os átomos EА e EВ , ligados por esta ligação, pertencem à mesma molécula; 2) intermolecular, se os átomos EА e EВ estão em moléculas diferentes. As pontes de hidrogênio intramoleculares desempenham um importante papel biológico, pois determinam, por exemplo, a estrutura helicoidal de moléculas de proteínas poliméricas. Nas proteínas, são ligações N-H ... O entre resíduos de aminoácidos. Igualmente importantes são as ligações de hidrogênio intermoleculares. Com a ajuda deles, as cadeias de ácidos nucléicos são conectadas, formando uma dupla hélice. Existem dois tipos de ligações entre as bases nucleicas - NHN e N-H-O. A energia cinética média do movimento térmico das moléculas é da ordem de 3/2RT. A uma temperatura do corpo humano de 37°C (310°K), isso é cerca de 4 kJ/mol. A força das ligações de hidrogênio está na faixa de 10 a 40 kJ / mol, portanto, são fortes o suficiente para suportar impactos constantes das moléculas circundantes e garantir a constância da forma das estruturas biológicas poliméricas. Ao mesmo tempo, durante os impactos de moléculas ativas, as ligações de hidrogênio são periodicamente quebradas e restauradas novamente, garantindo o fluxo de vários processos vitais. Os exemplos considerados ilustram claramente uma gama mais ampla de aplicações do método MO LCAO do que o método VS. No entanto, o método VS pode ser usado com sucesso para prever as propriedades e a estrutura de muitas substâncias, incluindo compostos complexos. 32. Macro e microelementos no meio ambiente e no corpo humano Existem várias classificações de elementos químicos contidos no corpo humano. Então, V. I. Vernadsky, dependendo do conteúdo médio (fração de massa w, %) em organismos vivos, dividiu os elementos de acordo com o sistema de dez dias. De acordo com essa classificação, os elementos contidos nos organismos vivos são divididos em três grupos: macro, micro e ultramicroelementos. Macronutrientes Estes são elementos cujo conteúdo no corpo é superior a 102%. Estes incluem oxigênio, carbono, hidrogênio, nitrogênio, fósforo, enxofre, cálcio, magnésio, sódio e cloro. Trace Elements São elementos cujo conteúdo no corpo está na faixa de 103 para 105%. Estes incluem iodo, cobre, arsênico, flúor, bromo, estrôncio, bário, cobalto. Ultramicroelementos Estes são elementos cujo conteúdo no corpo está abaixo de 105%. Estes incluem mercúrio, ouro, urânio, tório, rádio, etc. Atualmente, os ultramicroelementos são combinados com microelementos em um grupo. Esta classificação reflete apenas o conteúdo de elementos em organismos vivos, mas não indica o papel biológico e o significado fisiológico deste ou daquele elemento. V. V. Kovalsky, com base em sua importância para a vida, dividiu os elementos químicos em três grupos. Elementos vitais (insubstituíveis) Eles estão constantemente contidos no corpo humano, fazem parte de enzimas, hormônios e vitaminas: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Sua deficiência leva à interrupção da vida humana normal. elementos de impureza Esses elementos são constantemente encontrados no corpo de animais e humanos: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Seu papel biológico é pouco compreendido ou desconhecido. elementos de impureza Sc, Tl, In, La, Pr, Sm, W, Re, Tb, etc. Encontrados em humanos e animais. Os dados sobre o número e o papel biológico ainda não foram esclarecidos. Os elementos necessários para a construção e atividade vital de várias células e organismos são chamados de elementos biogênicos. Ainda é impossível listar com precisão todos os elementos biogênicos devido à dificuldade de determinar concentrações muito baixas de oligoelementos e estabelecer suas funções biológicas. Para 24 elementos, a biogenicidade foi estabelecida de forma confiável. Estes são elementos do primeiro e alguns elementos do segundo grupo (segundo Kowalski). 33. Topografia dos elementos biogênicos mais importantes do corpo humano Os órgãos humanos concentram de maneira diferente vários elementos químicos em si mesmos, ou seja, os micro e macro elementos são distribuídos de forma desigual entre os diferentes órgãos e tecidos. A maioria dos oligoelementos se acumula no fígado, ossos e tecidos musculares. Esses tecidos são os principais depósitos (armazéns) de muitos oligoelementos. Os elementos podem mostrar uma afinidade específica para certos órgãos e estar contidos neles em altas concentrações. É sabido que o zinco está concentrado no pâncreas, iodo - na tireoide, flúor - no esmalte dos dentes, alumínio, arsênico, vanádio se acumulam no cabelo e nas unhas, cádmio, mercúrio, molibdênio - nos rins, estanho - nos tecidos intestinais, estrôncio - na próstata, tecido ósseo, bário - no pigmento retina do olho, bromo, manganês, cromo - na glândula pituitária, etc. d. Nos organismos, os oligoelementos podem estar no estado ligado e na forma de formas iônicas livres. Sabe-se que o silício, o alumínio, o cobre e o titânio nos tecidos cerebrais estão na forma de complexos com proteínas, enquanto o manganês está na forma iônica. Hidrogênio e oxigênio são macronutrientes. Eles fazem parte da água, que no corpo de um adulto contém em média cerca de 65%. A água é distribuída de forma desigual sobre os órgãos humanos, tecidos e fluidos biológicos. Assim, no suco gástrico, saliva, plasma sanguíneo, linfa, a água é de 89,5 a 90%, na urina, massa cinzenta do cérebro, rins - 80%, na substância branca do cérebro, fígado, pele, medula espinhal, músculos, pulmões, coração - 70-80%. Menos de tudo - 40% de água - está contido no esqueleto. Os macronutrientes - carbono, hidrogênio, oxigênio, nitrogênio, enxofre, fósforo - fazem parte das proteínas, ácidos nucléicos e outros compostos biologicamente ativos do corpo. O teor de carbono nas proteínas é de 51-55%, oxigênio - 22-24%, nitrogênio - 15-18%, hidrogênio - 6,5-7%, enxofre - 0,3-2,5%, fósforo - cerca de 0,5%. Carbono, hidrogênio e oxigênio também fazem parte dos carboidratos, cujo teor nos tecidos animais é baixo - cerca de 2%. Esses elementos fazem parte dos lipídios (gorduras). Além disso, a composição dos fosfolipídios inclui fósforo na forma de grupos fosfato. Na maior parte, os lipídios estão concentrados no cérebro (12%), depois no fígado (5%), leite (2-3%) e soro sanguíneo (0,6%). No entanto, a maior parte do fósforo (600 g) encontra-se no tecido ósseo. Isso é 85% da massa de todo o fósforo no corpo humano. O fósforo também está concentrado nos tecidos duros dos dentes, nos quais está incluído junto com cálcio, cloro, flúor na forma de hidroxila, cloro, fluorapatitas de fórmula geral Ca5 (PO4)3X, onde X = OH, CI, F, respectivamente. O cálcio é predominantemente concentrado no osso, bem como nos tecidos dentários. Sódio e cloro são encontrados principalmente em fluidos extracelulares, enquanto potássio e magnésio são encontrados em fluidos intracelulares. Na forma de fluoretos, o sódio e o potássio fazem parte dos tecidos ósseo e dentário. Magnésio como Mg Fosfato3 (PO4)2 contidos nos tecidos duros do dente. Os hormônios estão envolvidos na manutenção de um certo conteúdo de macro e microelementos no corpo. 34. O papel biológico dos elementos químicos no corpo O papel biológico dos elementos químicos no corpo humano é extremamente diversificado. A principal função dos macronutrientes é construir tecidos, manter uma pressão osmótica constante, composição iônica e ácido-base. Os oligoelementos, fazendo parte de enzimas, hormônios, vitaminas, substâncias biologicamente ativas como agentes complexantes ou ativadores, estão envolvidos no metabolismo, processos de reprodução, respiração dos tecidos e neutralização de substâncias tóxicas. Os oligoelementos influenciam ativamente os processos de hematopoiese, oxidação, redução, permeabilidade dos vasos sanguíneos e tecidos. Macro e microelementos - cálcio, fósforo, flúor, iodo, alumínio, silício - determinam a formação dos tecidos ósseos e dentários. Muitas doenças associadas à deficiência ou acúmulo excessivo de vários oligoelementos foram identificadas. A deficiência de flúor causa cárie dentária, deficiência de iodo - bócio endêmico, excesso de molibdênio - gota endêmica. Tais padrões estão relacionados ao fato de que o equilíbrio das concentrações ideais de elementos biogênicos é mantido no corpo humano - homeostase química. A violação desse equilíbrio devido à falta ou excesso do elemento pode levar a várias doenças. Além dos seis principais macroelementos - organógenos (carbono, hidrogênio, nitrogênio, oxigênio, enxofre e fósforo), que compõem carboidratos, gorduras, proteínas e ácidos nucléicos, macroelementos inorgânicos - cálcio, cloro, magnésio, potássio, sódio - e microelementos - cobre, flúor, iodo, ferro, molibdênio, zinco e também, possivelmente (comprovado para animais), - selênio, arsênico, cromo, níquel , silício, estanho, vanádio. A análise do conteúdo e proporção de microelementos no corpo humano também é usada no exame médico forense. Por exemplo, no caso de intoxicação por álcool, sob a influência do álcool etílico, o teor de cálcio no fígado aumenta e o sódio e o potássio diminuem. Ao mesmo tempo, no coração e nos rins, pelo contrário, o teor de cálcio diminui. A falta de elementos como ferro, cobre, flúor, zinco, iodo, cálcio, fósforo, magnésio e alguns outros na dieta leva a graves consequências para a saúde humana. No entanto, deve-se lembrar que não apenas uma deficiência, mas também um excesso de elementos biogênicos é prejudicial ao organismo, pois isso perturba a homeostase química. Componentes minerais, que são vitais em quantidades insignificantes, tornam-se tóxicos em concentrações mais altas. Vários elementos (prata, mercúrio, chumbo, cádmio, etc.) são considerados tóxicos, pois sua entrada no corpo, mesmo em pequenas quantidades, leva a fenômenos patológicos graves. Vários elementos e seus compostos são amplamente utilizados como medicamentos. Assim, o estudo do papel biológico dos elementos químicos, a elucidação da relação entre a troca desses elementos e outras substâncias biologicamente ativas (enzimas, hormônios, vitaminas) contribui para a criação de novos medicamentos e o desenvolvimento de regimes de dosagem ideais para fins terapêuticos e profiláticos. 35. Elementos S e seus compostos A água é um dos compostos de hidrogênio mais importantes e difundidos na Terra. O espaço aquático ocupa quase 75% da superfície do globo. O corpo de um adulto contém em média 65-67% de água, o feto (4 meses) - 94%, em recém-nascidos - 74%. Todas as reações químicas no corpo ocorrem apenas no ambiente aquático. A vida sem água é impossível. A água destilada é uma preparação farmacopeica. Na prática médica, outro composto de hidrogênio é usado - peróxido de hidrogênio H2 02. Este composto é um importante subproduto do metabolismo. O peróxido de hidrogênio é um líquido incolor e transparente. Provoca queimaduras em contato com a pele e mucosas. Molécula H2О2 polar. A presença de pares solitários de elétrons nos átomos de oxigênio possibilita a formação de ligações doadoras-aceitadoras de peróxido de hidrogênio com ligantes - aceptores de elétrons. O estado de oxidação do oxigênio em H2О2 é igual a 1, ou seja, tem um valor intermediário entre o estado de oxidação do oxigênio na água (2) e no oxigênio elementar O2 . Segue-se que o peróxido de hidrogênio pode exibir tanto as propriedades de um agente oxidante quanto as propriedades de um agente redutor (dualidade redox). No entanto, a julgar pelos potenciais de semi-reação redox padrão, o peróxido de hidrogênio é mais caracterizado por propriedades oxidantes. O peróxido de hidrogênio puro é termodinamicamente instável e, em repouso, se decompõe explosivamente em água e oxigênio, liberando uma grande quantidade de calor. As soluções aquosas de peróxido de hidrogênio são mais estáveis, em local fresco podem ser armazenadas por muito tempo. O peróxido de hidrogênio é geralmente vendido na forma de uma solução aquosa a 30% - peridrol. O co-processo de decomposição do peróxido de hidrogênio é significativamente acelerado na presença de sais de metais pesados. A decomposição catalisada por íons metálicos do peróxido de hidrogênio pode levar à formação de radicais, sendo os mais importantes o hidróxido HO e o hidroperóxido. A toxicidade se deve ao fato de que2О2 e sobre2 interagem com a camada lipídica das membranas celulares e danificam-nas. Na prática médica, o peróxido de hidrogênio é usado principalmente como agente bactericida externo. Ação H2О2 baseado no poder oxidante do peróxido de hidrogênio e na inocuidade de seu produto redutor - a água. No tratamento de feridas, o oxigênio liberado desempenha um papel duplo: 1) tem efeito antimicrobiano, desodorizante e despigmentante, matando corpos microbianos; 2) forma espuma, contribuindo para a transição das partículas de decomposição do tecido para um estado suspenso e limpeza de feridas. Como preparação farmacopéica, é usada uma solução aquosa de peróxido de hidrogênio a 3%, uma solução de peróxido de hidrogênio a 6% é usada para descolorir o cabelo. Na forma de uma solução a 30%, o peróxido de hidrogênio é usado no tratamento da forma verrucosa do líquen plano e na remoção de verrugas juvenis. 36. O papel biológico dos elementos s do grupo IA (lítio, rubídio, césio, frâncio) De acordo com o conteúdo do corpo humano, o sódio (0,08%) e o potássio (0,23%) são macronutrientes, e o restante dos metais alcalinos é o lítio (104%), rubídio (105%), césio (104%) - para oligoelementos. Lítio O conteúdo de lítio no corpo humano é de cerca de 70 mg (10 mmol) - 104%. Os compostos de lítio em animais superiores estão concentrados no fígado, rins, baço, pulmões, sangue e leite. A quantidade máxima de lítio é encontrada nos músculos humanos. O papel biológico do lítio como oligoelemento ainda não foi totalmente elucidado. Está provado que ao nível das membranas celulares, os iões de Li (em uma concentração suficiente) competem com os iões de sódio ao penetrar nas células. Obviamente, a substituição de íons Na nas células por íons Li está associada a uma maior covalência dos compostos de lítio, pelo que eles se dissolvem melhor nos fosfolipídios. Foi estabelecido que alguns compostos de lítio têm um efeito positivo em pacientes com depressão maníaca. Absorvidos no trato gastrointestinal, os íons Li se acumulam no sangue. Quando a concentração de íons Li atinge 0,6 mmol / le acima, há uma diminuição da tensão emocional e um enfraquecimento da excitação maníaca. Ao mesmo tempo, o conteúdo de íons Li no plasma sanguíneo deve ser rigorosamente controlado. Nos casos em que a concentração de íons Li excede 1,6 mmol/l, fenômenos negativos são possíveis. rubídio e césio De acordo com o conteúdo de rubídio no corpo humano (105%) e césio (104%) pertencem a oligoelementos. Eles estão constantemente contidos no corpo, mas seu papel biológico ainda não foi elucidado. Sendo um análogo completo do potássio, o rubídio também se acumula no líquido intracelular e pode substituir uma quantidade equivalente de potássio em vários processos. isótopos radioativos 13rCs e 87O Rb é utilizado na radioterapia de tumores malignos, bem como no estudo do metabolismo do potássio. Devido à sua rápida decomposição, eles podem até ser introduzidos no corpo sem medo de efeitos nocivos a longo prazo. França Este é um elemento químico radioativo obtido por meios artificiais. Há evidências de que o frâncio pode se acumular seletivamente em tumores nos estágios iniciais de seu desenvolvimento. Essas observações podem ser úteis no diagnóstico de câncer. Assim, entre os elementos do grupo IA, Li, Rb, Cs são fisiologicamente ativos, enquanto Na e K são vitais. A proximidade das propriedades físico-químicas do Li e do Na, devido à semelhança da estrutura eletrônica de seus átomos, também se manifesta na ação biológica dos cátions (acumulação no líquido extracelular, intercambiabilidade). Uma natureza semelhante da ação biológica de cátions de elementos de grandes períodos - K+, Rb+,Cs+ (acumulação no fluido intracelular, intercambialidade) também se deve à semelhança de sua estrutura eletrônica e propriedades físico-químicas. Esta é a base para o uso de preparações de sódio e potássio em caso de envenenamento com sais de lítio e rubídio. 37. O papel biológico dos elementos s do grupo IA (sódio, potássio) O teor de sódio em um corpo humano pesando 70 kg é de cerca de 60 g (2610 mmol) - 0,08%. Dessa quantidade, 44% do sódio está no líquido extracelular e 9% no líquido intracelular. O restante do sódio fica no tecido ósseo, que é o local de deposição do íon Na no organismo. Cerca de 40% do sódio contido no tecido ósseo está envolvido em processos metabólicos e, devido a isso, o esqueleto é doador ou receptor de íons Na, o que ajuda a manter uma concentração constante de íons Na no líquido extracelular. O sódio é o principal íon extracelular. No corpo humano, o sódio está na forma de seus sais solúveis, principalmente cloreto, fosfato e hidrogenocarbonato. O sódio é distribuído por todo o corpo: no soro sanguíneo, líquido cefalorraquidiano, líquido ocular, sucos digestivos, bile, rins, pele, tecido ósseo, pulmões e cérebro. Os íons Na desempenham um papel importante na garantia da constância do ambiente interno do corpo humano, estão envolvidos na manutenção de uma pressão osmótica constante do biofluido (homeostase osmótica). Os íons Na estão envolvidos na regulação do metabolismo da água e afetam o funcionamento das enzimas. Juntamente com os íons K, Mg, Ca, Cl, o íon Na está envolvido na transmissão dos impulsos nervosos e mantém a excitabilidade normal das células musculares. Quando o teor de sódio no corpo muda, ocorrem disfunções dos sistemas nervoso, cardiovascular e outros, músculos lisos e esqueléticos. O cloreto de sódio NaCl é a principal fonte de ácido clorídrico para o suco gástrico. O sódio entra no corpo humano principalmente na forma de sal de mesa. A verdadeira necessidade diária de sódio do corpo é de 1 g, embora a ingestão média desse elemento atinja 4 a 7 g. A ingestão excessiva contínua de NaCl contribui para a hipertensão. Sob a influência de álcalis nas células microbianas, ocorre a precipitação de proteínas celulares e, como resultado, a morte de microrganismos. Sulfato de sódio (sal de Glauber) Na2SO4 × 10H2O é usado como um laxante. Tetraborato de sódio Na2B4О7 × 10H2O é usado externamente como anti-séptico para enxaguar, ducha, lubrificar. O hidróxido de sódio na forma de solução a 10% faz parte da silina utilizada na prática ortopédica para fundição de modelos refratários na fabricação de próteses fundidas a partir de uma liga de cobalto-cromo. O teor de potássio em um corpo humano de 70 kg é de aproximadamente 160 g (4090 mmol) - 0,23%. O potássio é o principal cátion intracelular, respondendo por 2/3 do número total de cátions celulares ativos. Da quantidade total de potássio contida no corpo, 98% está localizada no interior das células e apenas cerca de 2% está no líquido extracelular. O potássio é distribuído por todo o corpo. Sua topografia: fígado, rins, coração, tecido ósseo, músculos, sangue, cérebro, etc. Os íons K desempenham um papel importante nos processos fisiológicos - contração muscular, funcionamento normal do coração, condução de impulsos nervosos, reações metabólicas. Os íons K são importantes ativadores de enzimas localizadas no interior da célula. 38. Papel biológico dos elementos s do grupo IIA. Seu uso na medicina (berílio, magnésio, cálcio) Berílio é encontrado em plantas, bem como em organismos animais. O conteúdo de berílio em organismos vivos é de 107%, ou seja, é um ultramicroelemento de impureza. O papel biológico do berílio não foi suficientemente estudado. Os compostos de berílio são tóxicos e causam uma série de doenças (raquitismo berílio, beriliose, etc.). Compostos voláteis de berílio são especialmente tóxicos. O efeito negativo do Be2+ nos processos fisiológicos é explicado por suas propriedades químicas. O magnésio é formalmente um macronutriente. Seu conteúdo total no corpo é de 0,027% (cerca de 20 g). A topografia do magnésio no corpo humano é a seguinte: o magnésio concentra-se principalmente na dentina e no esmalte dos dentes, no tecido ósseo. Também se acumula no pâncreas, músculos esqueléticos, rins, cérebro, fígado e coração. Em um adulto, a necessidade diária de magnésio é de cerca de 0,7 g. O íon Mg, como o íon K, é um cátion intracelular. Nos fluidos biológicos e tecidos do corpo, o magnésio é encontrado tanto na forma de um íon aquático quanto no estado ligado a proteínas em uma quantidade < 102%, ou seja, em essência, é um microelemento. A concentração de íons Mg dentro das células é aproximadamente 2,5-3 vezes maior do que nos fluidos extracelulares. Os íons de magnésio desempenham um importante papel biológico no corpo humano. Devido ao menor raio do íon e à maior energia de ionização do Mg2+ forma ligações mais fortes do que o íon Ca e, portanto, é um catalisador mais ativo para processos enzimáticos. Fazendo parte de vários sistemas enzimáticos, o íon Mg é seu componente indispensável e ativador (enzimas como carboxipeptidase, colinesterase e algumas outras são específicas do íon Mg). A hidrólise do ATP, associada a várias reações enzimáticas, como resultado da formação da hidrofosfação HPO2 e da liberação de uma grande quantidade de energia, ocorre com excesso de Mg2+. O cálcio é um macronutriente. Seu conteúdo total no corpo é de 1,4%. O cálcio é encontrado em todas as células do corpo humano. A maior parte do cálcio é encontrada nos tecidos ósseos e dentários. Em média, um adulto deve consumir 1 g de cálcio por dia, embora a necessidade de cálcio seja de apenas 0,5 g. O cálcio administrado com alimentos é apenas 50% absorvido no intestino. A absorção relativamente fraca é uma consequência da formação no trato gastrointestinal de fosfato de cálcio pouco solúvel Ca3(PO4)2 e sais de cálcio de ácidos graxos. No corpo, a concentração de íons Ca é regulada por hormônios. Nos ossos e dentes de um adulto, cerca de 1 kg de cálcio está na forma de um mineral cristalino insolúvel - hidroxiapatita Ca10(RO4)6(ELE)2 , cuja formação ocorre durante a interação dos íons Ca com a fosfatação. No sangue e na linfa, o cálcio é encontrado tanto no estado ionizado quanto no não ionizado - em compostos com proteínas, carboidratos, etc. O mecanismo de coagulação do sangue consiste em várias etapas, dependendo da presença de Ca ionizado. Os íons Ca estão envolvidos na transmissão de impulsos nervosos, contração muscular, regulação do músculo cardíaco. A concentração de íons Ca dentro e fora da célula, respectivamente, é 106 e (2,25-2,8) 103 mol/l. Como o cálcio praticamente não é usado dentro da célula, ele atua como material de construção no corpo - nos ossos, dentes. O esqueleto é a principal reserva de cálcio do corpo. 39. Papel biológico dos elementos d do grupo VIB. Seu uso na medicina O cromo é encontrado em organismos vegetais e animais. O corpo de um adulto contém aproximadamente 6 g de Cr (0,1%). O cromo metálico não é tóxico, enquanto os compostos Cr(III) e Cr(VI) são perigosos para a saúde. Eles causam irritação na pele, o que leva à dermatite. Existe uma suposição de que os derivados de cromo (VI) têm propriedades cancerígenas. 0,25-0,3 g de dicromato de potássio causam a morte. Os compostos de cromo (VI) são usados \uXNUMXb\uXNUMXbcomo fungicidas (agentes de decapagem, fungos - "cogumelo", caldere - "matar"). Os compostos de cromo (III) têm um efeito benéfico no crescimento das plantas. O molibdênio pertence aos "metais da vida", sendo um dos bioelementos mais importantes. Sua posição especial foi observada há 20-25 anos por F. Krin e L. Oril. Esses cientistas apresentam a ideia de que o surgimento da vida na Terra não ocorreu por evolução, mas que foi trazido por uma civilização desconhecida do espaço de estrelas de molibdênio, onde a vida existia muito antes de nós. Nos processos bioquímicos, o molibdênio está envolvido nos estados de oxidação VI e VI. Nesses estados, cria formas oxo estáveis. O molibdênio forma complexos oxo estáveis e, aparentemente, portanto, faz parte das enzimas que asseguram a transferência de grupos oxo. Mo (VI) predomina no sangue; se o ligante for oxigênio, então isopolimolibdações estáveis são formadas. O conteúdo excessivo de molibdênio nos alimentos interrompe o metabolismo do Ca2+ e RO4 , causando uma diminuição na resistência óssea - osteoporose. Talvez ocorra a ligação a complexos de fosfomolibdênio. Tais complexos podem ser considerados como resíduos ácidos de ácidos heteropolimolibdicos. Com o cálcio, esses resíduos formam cristais insolúveis. É possível que esses cristais iniciem a deposição de sais de ácido úrico e causem gota. A gota deforma as articulações, justificando sua tradução literal - "pegada armadilha". Além dos complexos de oxigênio, o molibdênio forma complexos de haleto (Hal), tiocianato (NCS) e cianeto (CN). O molibdênio é um constituinte de várias enzimas. No corpo humano, estes incluem aldeído hidroxidases, xantina desidrogenases e xantina oxidases. O peso molecular da xantina oxidase (COX) é de 250 a.u. e. m. Esta é uma enzima de mamíferos contendo molibdênio. Pode catalisar a oxidação de xantina e outras purinas, bem como aldeídos. A conversão de hipoxantina e xantina em ácido úrico é catalisada pela xantina oxidase. Supõe-se que durante o processo catalítico, o molibdênio forma uma ligação com o nitrogênio e o oxigênio da xantina. O molibdênio é o microelemento mais importante das plantas, pois as substâncias biologicamente ativas com sua participação proporcionam uma fixação suave do nitrogênio: convertem-no em amônia ou produtos contendo nitrogênio. Comparado a outros metais industrialmente importantes, o molibdênio tem baixa toxicidade. O consumo de molibdênio com alimentos é de 0,1 a 0,3 mg / dia, mas a ingestão diária necessária não foi estabelecida. A deficiência de molibdênio causa uma diminuição na atividade da xantina oxidase nos tecidos. O conteúdo excessivo de molibdênio causa osteoporose. O tungstênio é um oligoelemento. Seu papel no corpo não é bem compreendido. A forma aniônica do tungstênio é facilmente absorvida no trato gastrointestinal. O tungstênio metálico e suas formas catiônicas não são absorvidos pelo corpo. Não há informações sobre a homeostase do tungstênio em mamíferos. 40. Papel biológico dos compostos de manganês. Seu uso na medicina Dos elementos do grupo VIIB, apenas o manganês é um elemento biogênico e um dos dez "metais da vida" necessários para o curso normal dos processos nos organismos vivos. O corpo de um adulto contém 12 mg. O manganês está concentrado nos ossos (43%), o restante - em tecidos moles, incluindo o cérebro. No corpo, o manganês forma complexos metálicos com proteínas, ácidos nucleicos, ATP, ADP, aminoácidos individuais. Contém manganês metaloenzimas arginase, colinesterase, fosfoglucomutase, piruvato carboxilase. A ligação da amônia - produto tóxico da transformação de aminoácidos no organismo dos mamíferos - é realizada por meio do aminoácido arginina. A arginase é uma enzima que catalisa a hidrólise da arginina no fígado. Como resultado, a arginina é decomposta em ureia e no aminoácido cíclico ornitina. A ureia é uma substância não tóxica e solúvel em água. É transportado pela corrente sanguínea para os rins e excretado na urina. O raio atômico do manganês é 128 pm. Isso explica o fato de que o manganês pode substituir o magnésio (raio atômico 160 pm) em sua combinação com o ATP, afetando significativamente a transferência de energia no corpo. Os íons Mg e Mn também realizam a ativação de enzimas - nucleases. Essas enzimas catalisam a hidrólise de ácidos nucléicos de DNA e RNA no duodeno. Como resultado, esses biopolímeros são divididos em unidades monoméricas - nucleotídeos. Em particular, essa nuclease é a desoxirribonuclease, que catalisa a hidrólise do DNA apenas na presença de Mg2+ ou MP2+. O manganês também pode ser incluído na composição de compostos inorgânicos do corpo. Este, por exemplo, é um pirofosfato de magnésio e manganês pouco solúvel MnMgP2O7. Os cristais deste sal estão localizados na superfície interna da membrana da vesícula. Quase o mesmo valor do raio atômico do manganês e do ferro explica a capacidade do manganês de substituir o ferro no complexo de porfirina eritrocitária. Pela mesma razão, o manganês também pode substituir o zinco em enzimas zinco-dependentes, alterando assim suas propriedades catalíticas. Permanganato de potássio KMnO4 - o composto de manganês mais famoso usado na medicina. Use soluções aquosas contendo KMnO4 0,01-5%. Uma solução a 5% é usada como agente hemostático. As soluções de permanganato de potássio possuem propriedades antissépticas, que são determinadas por seu alto poder oxidante. Dos outros compostos de manganês, destacam-se o sulfato de manganês (II) e o cloreto de manganês (II), usados no tratamento da anemia. Não há dados sobre a presença de tecnécio em organismos vivos. No entanto, compostos de tecnécio com bifosfonatos são usados para o método de diagnóstico de radioisótopos. 41. O papel biológico dos compostos de ferro. Hemoglobina O ferro é um elemento biogênico encontrado nos tecidos de animais e plantas. A massa total de ferro no corpo de um adulto é de aproximadamente 5 g, que é 0,007%. O ferro metálico é pouco tóxico, e compostos de Fe (II), Fe (III) e Fe (VI) em grandes quantidades são perigosos para a saúde. Mioglobina, citocromos, catalase fornecem respiração celular. Todas essas proteínas consistem em suas próprias partes proteicas e centros ativos associados a elas. O centro ativo é um composto complexo macrocíclico - heme. O composto porfirina atua como um ligante macrocíclico. Os átomos de nitrogênio doadores estão localizados nos cantos de um quadrado, no centro do qual existe um íon Fe. Em geral, o complexo tem uma configuração octaédrica. O quinto orbital através do nitrogênio do aminoácido (histidina) é usado para ligar o heme à proteína. A hemoglobina consiste em 4 moléculas de proteína (subunidades) que formam um único agregado macromolecular. Cada subunidade é semelhante em estrutura à molécula de mioglobina. Assim, a hemoglobina pode se ligar simultaneamente a quatro moléculas de O2 , e mioglobina - 1. Existem também vários complexos proteicos contendo ferro não heme nos tecidos. Estas são, por exemplo, enzimas - oxidases, bem como proteínas - armazenamento (depósito) e transportadores de ferro. O excesso de ferro é transportado no sangue pela proteína transferrina e se acumula na forma de proteína ferritina em vários tecidos e órgãos, especialmente no fígado, baço e medula óssea. A ferritina consiste em 24 moléculas de proteína (subunidades) que formam uma esfera com um diâmetro de 12-14 nm. Cada subunidade contém uma cavidade de 7 nm de diâmetro contendo até 4500 átomos de ferro. Assim, cada agregado de ferritina pode armazenar aproximadamente 100 átomos de ferro, proporcionando inúmeras reações metabólicas envolvendo esse elemento. Com base nas leis do equilíbrio químico, não é difícil entender o funcionamento da hemoglobina como carreadora de oxigênio dos pulmões para os tecidos. A hemoglobina sem oxigênio (desoxiemoglobina) é um ácido fraco e sua fórmula química pode ser representada como HHb+. A adição de oxigênio é acompanhada pela eliminação de um próton e a oxiemoglobina HbO é formada.2 . Neste caso, há um equilíbrio: HHb+ + O2 →HbO2 + N+. Quando o sangue venoso pobre em oxigênio entra nos pulmões, onde a pressão parcial de oxigênio é alta (até 20 kPa), sua solubilidade aumenta de acordo com a lei de Henry. Isso leva, de acordo com o princípio de Le Chatelier, a um deslocamento do equilíbrio para a direita e à formação de oxiemoglobina. Um deslocamento adicional do equilíbrio para a direita deve-se ao fato de que nos pulmões o valor do pH é aumentado (até 7,5). Como resultado, nos pulmões, a desoxiemoglobina é quase completamente (até 97%) saturada com oxigênio e passa para a oxiemoglobina. Nos capilares que penetram nos tecidos periféricos, a pressão parcial do oxigênio diminui para 5 kPa e o valor do pH diminui para 7,2. Como resultado, o equilíbrio se desloca para a esquerda. No sangue que flui da periferia, a hemoglobina está saturada com oxigênio apenas em 65%. 42. O papel biológico dos compostos de ferro. CO monóxido de carbono. As propriedades do complexo metálico das proteínas contendo heme se manifestam sob a ação de substâncias tóxicas como CO (monóxido de carbono) e MCN (cianetos - sais de ácido cianídrico). As mais importantes do ponto de vista fisiológico são as proteínas contendo ferro: hemoglobina, mioglobina, citocromos, peroxidases, catalase. A hemoglobina - o principal componente dos glóbulos vermelhos, fornece respiração externa, sendo um transportador de oxigênio dos pulmões para os tecidos. Ferro Fe e cobalto Co são oligoelementos essenciais de organismos vivos. O monóxido de carbono CO é um dos produtos da combustão incompleta do combustível. Quantidades significativas desse gás são emitidas durante a operação de caldeiras, motores de combustão interna e fumaça. Quando o CO é inalado com o ar nos pulmões em paralelo com a oxiemoglobina HbO2 um composto complexo de metal é formado - carbonil hemoglobina HbCO. A constante de estabilidade da HbCO é cerca de 200 vezes a da HbO2 . Portanto, mesmo pequenas quantidades de CO "interceptam" uma proporção significativa de desoxihemoglobina, como resultado, o suprimento de oxigênio para os órgãos diminui. Existem sinais de hipóxia - deficiência de oxigênio. O tecido nervoso é o primeiro a ser afetado. Para desintoxicar (eliminar o efeito tóxico) do monóxido de carbono, em muitos casos basta interromper seu fornecimento e aumentar a ventilação de oxigênio - levar a vítima ao ar livre. Nesse caso, o princípio de Le Chatelier funciona novamente - o equilíbrio muda para a formação de oxi-hemoglobina. Em altas concentrações, o monóxido de carbono bloqueia as proteínas da respiração celular contendo heme, e é difícil evitar um resultado letal. O mecanismo de ação dos cianetos é semelhante, mas sua toxicidade é maior que a do CO. A entrada no sangue mesmo de quantidades muito pequenas dessas substâncias leva à parada respiratória e à morte. A alta toxicidade dos cianetos é explicada pela alta força da ligação Fe-CN-, que determina a maior estabilidade da hemoglobina cianeto. A respiração de oxigênio leva à formação de peróxido de hidrogênio H2O2 . Esta substância tem um alto poder oxidante. Quando interage com os compostos bioorgânicos das células, formam-se radicais - partículas moleculares muito ativas com valência insaturada e inicia-se a oxidação do peróxido. Sob a influência dos radicais, os componentes mais importantes da célula - membranas e DNA - são destruídos. No curso da evolução biológica, a natureza desenvolveu uma proteína especial - a enzima catalase, que destrói o peróxido de hidrogênio. Isso limita o acúmulo excessivo dessa substância e evita a destruição da célula. A ação da catalase (CatFe2+ ) pode ser representado como um ciclo catalítico de duas reações sucessivas: catfe2+ + N2O2 - Gato Fe2+ × H2O2 , catfe2+ × H2O2 + N2O2 → Gato Fe2+ + 2N2O2 + O2 . Como resultado, 2 moléculas de peróxido de hidrogênio são destruídas e a molécula do biocatalisador CatFe2+ é liberada e pode entrar no próximo ciclo catalítico. Este processo é muito rápido. Em um segundo, 1 molécula de catalase pode realizar até 20 ciclos. 43. O papel biológico dos compostos de ferro e cobalto Com a falta de ferro no corpo, uma doença pode se desenvolver - anemia por deficiência de ferro (anemia). Há deficiência de oxigênio tecidual associada à falta de ferro para a síntese de hemoglobina. Como resultado, o fornecimento de oxigênio aos órgãos periféricos diminui e, consequentemente, o nível de respiração celular diminui e o metabolismo diminui. A introdução de cloreto de ferro (II) ou sulfato de ferro (II) como drogas reduz a gravidade da doença. Para os mesmos fins, é utilizado um pó fino de ferro metálico (ferro reduzido, até 1 g por dose), que é facilmente solúvel em ácido clorídrico do suco gástrico. Portanto, a ação desta droga é semelhante à do cloreto de ferro (II). No entanto, drogas que são complexos bioinorgânicos de ferro com açúcares, nicotinamida e outras substâncias orgânicas são mais eficazes. Tais complexos são bem absorvidos no sangue, razão pela qual sua eficácia farmacológica. É interessante notar que, desde a antiguidade até hoje, o chamado vinho de ferro é usado para tratar a anemia por deficiência de ferro - uma bebida que é obtida pela infusão de vinho de uva em limalhas de ferro. Obviamente, o ferro se dissolve no vinho (ambiente ácido) e forma complexos com substâncias orgânicas naturais, contidas nele em grandes quantidades. É claro que o mecanismo de ação da bebida antiga é aproximadamente o mesmo das drogas modernas. Assim como o ferro, o cobalto também é um dos elementos biogênicos mais importantes. A massa total de cobalto no corpo de um adulto é de aproximadamente 1,2 mg, que é inferior a 10%. Cerca de 100 mg desta massa está na forma de cianocobalamina (vitamina B lipossolúvel12 ) e seus análogos. Esta substância, como o heme, é um composto complexo macrocíclico. Um composto tetradentado, a porfina, atua como um ligante macrocíclico. R é um substituinte orgânico complexo. Nos análogos da cianocobalamina, vários substituintes orgânicos atuam em vez do ânion CN. O papel mais importante da vitamina B12 desempenha no desenvolvimento e formação de glóbulos vermelhos (eritropoiese). Deficiência de vitamina B12 (receber menos de 3 mcg por dia) leva a uma doença grave - anemia perniciosa (anemia). Foi estabelecido que os análogos da cianocobalamina são ativadores - cofatores de várias enzimas envolvidas na eritropoiese. A falta de cofatores se manifesta na deficiência de hemoglobina e eritrócitos. Plantas e animais não podem sintetizar vitamina B12. É produzido apenas por certos tipos de bactérias. Essas bactérias estão presentes no trato gastrointestinal humano. Eles sintetizam vitamina B suficiente12. A anemia perniciosa está associada à absorção prejudicada dessa vitamina no sangue. Portanto, tomar pílulas é ineficaz. Uma injeção de vitamina (100-200 mcg por 2 dias) no sangue melhora significativamente a condição do paciente com anemia maligna. 44. O papel dos elementos d do grupo IB. O uso de seus compostos na medicina O cobre Cu é um microelemento essencial dos organismos vivos. Prata Ag e ouro Au são oligoelementos de impurezas. Seus compostos são usados na medicina. O cobre é um elemento biogênico encontrado nos tecidos de animais e plantas. A massa total de cobre no corpo de um adulto é de aproximadamente 100 mg, que é cerca de 0,0001%. Aproximadamente 30% dessa quantidade é encontrada nos músculos. O fígado e o cérebro também são ricos em cobre. O cobre metálico e seus compostos são tóxicos. As mais importantes do ponto de vista fisiológico são as proteínas contendo cobre - citocromo oxidase e superóxido dismutase. A citocromo oxidase é um dos componentes da cadeia respiratória localizada nas membranas mitocondriais. Fornece a respiração celular reduzindo o oxigênio a água no final da cadeia respiratória. O corpo precisa de 2,5-5,0 mg de cobre diariamente. Com a falta de cobre no corpo, uma doença pode se desenvolver - anemia por deficiência de cobre. O cobre é necessário para a absorção de ferro, em particular, na síntese da citocromo oxidase, que contém ferro e cobre. Com a deficiência de cobre, o desenvolvimento normal dos tecidos conjuntivos e vasos sanguíneos é interrompido. O envenenamento geralmente está associado a uma overdose acidental de inseticidas, inalação de pó metálico, ingestão de soluções salinas de cobre. Bebidas armazenadas em recipientes de cobre sem revestimento protetor das paredes são de grande perigo. Como agente externo, é utilizada uma solução aquosa a 0,25% de sulfato de cobre CuSO.4 com inflamação das membranas mucosas e conjuntivite. Pequenas doses deste medicamento podem ser tomadas com alimentos para aumentar a eritropoiese na anemia. Prata e ouro No corpo de um adulto, encontram-se cerca de 1 mg de prata, ou seja, aproximadamente 10% (1 parte por milhão), e até 10 mg de ouro, ou seja, aproximadamente 10% (10 partes por milhão). As propriedades anti-sépticas dos sais de prata solúveis são conhecidas desde os tempos antigos. Os sacerdotes sabem há muito tempo que a água ("santa"), quando armazenada em vasos de prata, não se deteriora por muito tempo, ou seja, não está sujeita à contaminação microbiana. Atualmente, esta propriedade de água "prata" é utilizada por marinheiros em viagens de longa distância. Fortes manifestações tóxicas em um adulto são observadas quando 7 g de AgNO são ingeridos.3. Na medicina, drogas como o nitrato de prata cristalino AgNO03 (lápis) e suas soluções aquosas têm sido usadas há muito tempo. As preparações de prata metálica coloidal protargol (8% Ag) e Collargol (70% Ag) são conhecidas há muito tempo, que são pós finos com brilho metálico. Cada partícula desses pós é um cristal de prata metálica reduzida com menos de 1 μm de tamanho com uma casca de proteína de albumina (protargol) ou colágeno (colargol). O invólucro de proteína protege os cristais de prata da aderência e garante sua transição para o meio aquoso (solubiliza). As preparações de prata são usadas como agentes anti-inflamatórios, anti-sépticos e adstringentes. As preparações de ouro também são usadas como drogas anti-inflamatórias eficazes. Os mais conhecidos são o krizanol com teor de 30% do metal nobre e o ouro coloidal. 45. Papel biológico dos elementos d do grupo IIB. O uso de seus compostos na medicina Zinco Zn, cádmio Cd, mercúrio Hg são oligoelementos. O corpo de um adulto contém 1,8 g de Zn, 50 mg de Cd, 13 mg de Hg. Cádmio e mercúrio são elementos impuros. Cerca de 70% do mercúrio está concentrado nos tecidos adiposo e muscular. O cádmio está localizado em 30% nos rins, o restante - no fígado, pulmões, pâncreas. O zinco é um elemento essencial para todas as plantas e animais. No corpo de um adulto, a maior parte do zinco nos músculos (65%) e ossos (20%). O restante da quantidade cai no plasma sanguíneo, fígado, eritrócitos. A maior concentração de zinco na próstata. O zinco não apresenta valência variável. Aparentemente, portanto, seus biocomplexos participam de muitas reações bioquímicas de hidrólise que ocorrem sem transferência de elétrons. O íon Zn faz parte de mais de 40 metaloenzimas que catalisam a hidrólise de ésteres e proteínas. Um dos mais estudados é o complexo bioinorgânico de zinco - a enzima anidrase carbônica (Mg = 30), composto por cerca de 000 resíduos de aminoácidos. O zinco não faz parte das dipeptidases - enzimas que catalisam a hidrólise de dipeptídeos (substâncias compostas por 2 aminoácidos). O zinco forma um complexo bio-inorgânico com a insulina, um hormônio que regula o açúcar no sangue. A necessidade humana de zinco é totalmente satisfeita por produtos alimentícios: carne, laticínios, ovos. Com a falta de zinco nas plantas, o metabolismo de proteínas e carboidratos é perturbado, a síntese de clorofila e vitaminas é inibida. A deficiência de zinco é eliminada usando fertilizantes contendo zinco. A toxicidade dos compostos do grupo IIB aumenta do zinco ao mercúrio. Compostos solúveis em água irritam a pele e causam envenenamento se ingeridos. Os próprios metais também são tóxicos - ao inalar o vapor de zinco (o ar da produção de zinco), surge uma febre "metálica". O envenenamento por vapor de mercúrio na Idade Média foi chamado de "doença do chapeleiro maluco". O conteúdo de mercúrio nos alimentos (na marinha, como no Japão) leva à doença de minomata. A toxicidade do mercúrio está associada à aglutinação (aderência) dos glóbulos vermelhos, inibição de enzimas. Por exemplo, o sublimado causa uma mudança de tamanho, fragilidade osmótica e diminuição da deformabilidade dos glóbulos vermelhos, necessária para sua movimentação pelos capilares. A toxicidade do cádmio está relacionada com a sua afinidade pelos ácidos nucleicos. Como resultado de sua ligação com o DNA, seu funcionamento é interrompido. A toxicidade crônica do cádmio e do mercúrio pode prejudicar a mineralização óssea. Elementos tóxicos podem substituir o cálcio. Isso leva à formação de apatita com uma estrutura imperfeita devido à distorção dos parâmetros do componente cristalino do tecido ósseo. Como resultado, a resistência óssea diminui. 46. Propriedades tóxicas dos compostos do grupo IIB (Zn, Cd, Hg) Os compostos Zn, Cd, Hg podem causar uma violação do metabolismo das proteínas, que se manifesta na liberação de proteínas plasmáticas pelos rins (na proteinúria). O efeito tóxico dos compostos do grupo IIB no corpo também é causado pelo fato desses íons metálicos interagirem com grupos sulfidrila SH de proteínas, enzimas e aminoácidos. Quando os íons metálicos interagem com os grupos SH, formam-se compostos fracamente dissociados e, via de regra, insolúveis. Portanto, o bloqueio dos grupos sulfidrila leva à supressão da atividade enzimática e do enovelamento de proteínas. Os íons metálicos divalentes bloqueiam simultaneamente dois grupos SH. Em reações desse tipo, os íons metálicos atuam como aceptores e o enxofre atua como doador de elétrons. A afinidade química mais pronunciada para grupos SH no mercúrio. Obviamente, isso se deve ao fato de que as propriedades complexantes do mercúrio são maiores e forma ligações mais fortes com o enxofre. Os grupos SH fazem parte de mais de 100 enzimas, cuja atividade pode ser suprimida devido ao bloqueio desses grupos. Portanto, é óbvio o quão importante é conhecer o mecanismo de bloqueio e os métodos de tratamento para envenenar o corpo com metais. Sabe-se que as propriedades tóxicas dos elementos dependem da forma química em que entram no corpo. As formas mais tóxicas são aquelas que se dissolvem em lipídios e penetram facilmente através da membrana na célula. A literatura descreve um caso de intoxicação em massa por mercúrio no Japão. Compostos inorgânicos de mercúrio foram convertidos em metilmercúrio sob a ação de enzimas microbianas. O metilmercúrio se acumulou nos peixes e depois entrou no corpo humano com os alimentos. Concentrando-se gradualmente, o metilmercúrio causa destruição irreversível no corpo e morte. O uso de compostos de zinco e mercúrio na medicina é baseado em seus efeitos adstringentes, cauterizantes e antissépticos. Como colírio, uma solução aquosa a 0,25% de sulfato de zinco ZnSO é usada.4. Na odontologia, o cloreto de zinco é usado para cauterizar papilomas, para tratar membranas mucosas inflamadas. O óxido de zinco ZnO também é usado. O cloreto de mercúrio (II) (cloreto de mercúrio) é muito tóxico, e suas soluções aquosas em altas diluições (1:1000) são usadas para desinfecção. Para o tratamento de doenças de pele e doenças sexualmente transmissíveis, são utilizadas pomadas contendo óxido de mercúrio (II) HgO e sulfeto de mercúrio (II) HgS. O cloreto de mercúrio(I) (calomelano) é pouco solúvel em água e, portanto, ligeiramente tóxico. Este sal é usado na medicina veterinária como laxante. O mercúrio em condições normais é um metal líquido que pode dissolver outros metais. Nesse caso, ligas duras - amálgamas - são formadas. Na odontologia, os amálgamas de prata e cádmio são usados há muito tempo para obturar os dentes. Eles são quimicamente inertes, amolecem facilmente quando aquecidos e, portanto, fáceis de formar. Fontes de luz ultravioleta - lâmpadas de quartzo de mercúrio para fins médicos - contêm mercúrio gasoso (vapores). Quando irradiados com a luz dessas lâmpadas em quartos hospitalares, os microorganismos contidos no ar são destruídos. Com a ajuda dos raios ultravioleta, várias doenças de pele são tratadas. Assim, de acordo com a natureza de funcionamento e impacto no corpo, os metais do grupo IIB podem ser divididos em elemento vital Zn e elementos de impureza tóxica Cd e Hg. 47. Papel biológico dos elementos p do grupo IIIA. O uso de seus compostos na medicina O boro é um oligoelemento de impureza, sua fração de massa no corpo humano é de 105%. O boro está concentrado principalmente nos pulmões (0,34 mg), glândula tireóide (0,30 mg), baço (0,26 mg), fígado, cérebro (0,22 mg), rins, músculo cardíaco (0,21 mg). O efeito biológico do boro ainda não foi suficientemente estudado. O boro é conhecido por estar presente em dentes e ossos, aparentemente na forma de sais pouco solúveis de ácido bórico com cátions metálicos. O excesso de boro é prejudicial ao corpo humano. Há evidências de que o excesso de boro inibe amilases, proteinases e reduz a atividade da adrenalina. De acordo com o conteúdo no corpo humano (105%), o alumínio pertence aos microelementos de impureza. O alumínio está concentrado principalmente no soro sanguíneo, pulmões, fígado, ossos, rins, unhas, cabelos, entra na estrutura das bainhas nervosas do cérebro humano. A ingestão diária de alumínio por um ser humano é de 47 mg. O alumínio afeta o desenvolvimento dos tecidos epiteliais e conjuntivos, a regeneração do tecido ósseo, afeta a troca de fósforo. O alumínio tem um efeito nos processos enzimáticos. Um excesso de alumínio no organismo inibe a síntese de hemoglobina, pois devido à sua alta capacidade de complexação, o alumínio bloqueia os centros ativos das enzimas envolvidas na hematopoiese. Há evidências de que o alumínio pode catalisar a reação de transaminação. O gálio é um oligoelemento de impureza (o conteúdo no corpo humano é 10-6-10-5%). O papel biológico do gálio em organismos vivos quase não é claro. O tálio é um elemento altamente tóxico. O íon T1 tende, como Ag+, a formar compostos fortes com ligantes contendo enxofre. Como resultado, é muito tóxico, pois inibe a atividade de enzimas contendo grupos tio - SH. Mesmo quantidades muito pequenas de compostos T1+, quando ingeridas, causam queda de cabelo. Devido à proximidade dos raios K+ e T1+ eles têm propriedades semelhantes e são capazes de se substituir em enzimas. Os íons T1 e K são sinergistas. Isso explica o fato de que as enzimas piruvato quinase e diol desidratase são ativadas não apenas por íons K, mas também por íons T1 (o íon T1 substitui o íon K no centro catalítico das enzimas). O sinergismo do tálio e do potássio também se manifesta no fato de que, como os íons K, os íons T1 se acumulam nos eritrócitos. Como antídoto para envenenamento com íons T1, um ligante contendo enxofre, o aminoácido cistina, é usado. Em conclusão, deve-se notar que o papel biológico dos elementos p do grupo IIIA não foi suficientemente estudado. Sabe-se agora que o boro e o gálio interagem nas plantas com polifenóis, inibidores do seu desenvolvimento, reduzindo a toxicidade destes últimos. Também foi estabelecido o papel indiscutível do alumínio na construção dos tecidos epiteliais e conjuntivos e, além disso, sua participação nos processos enzimáticos, tanto como ativador quanto como inibidor. O íon T1 tem a capacidade de inibir muitas enzimas contendo enxofre. A atividade biológica dos elementos do grupo IIIA está principalmente relacionada à sua capacidade de formar compostos complexos com ligantes contendo oxigênio e fosfatos insolúveis. 48. Papel biológico dos elementos p do grupo IVA. O uso de seus compostos na medicina De acordo com o conteúdo no corpo humano (21,15%), o carbono pertence aos macronutrientes. É uma parte de todos os tecidos e células na forma de proteínas, gorduras, carboidratos, vitaminas, hormônios. Do ponto de vista biológico, o carbono é o organogênio número 1. De acordo com o conteúdo no corpo humano (103% ־), o silício pertence aos microelementos de impureza. Mais silício no fígado, glândulas supra-renais, cabelo, lente. Como o dióxido de silício natural é pouco solúvel em água, ele entra no corpo humano não tanto pelo trato digestivo, mas pelo ar através dos pulmões na forma de SiO empoeirado.2. Com uma violação do metabolismo do silício, a ocorrência de hipertensão, reumatismo, úlceras, anemia está associada. Na prática médica, o carbeto de silício (IV) SiC é usado - carborundum para moagem de obturações e próteses plásticas. Dióxido de Silício SiO2 parte de cimentos de silicato. Deve-se notar que a poeira composta por partículas de carvão, dióxido de silício e alumínio, quando exposta sistematicamente aos pulmões, causa uma doença - pneumoconiose. Sob a ação do pó de carvão, ocorre a antracose, doença ocupacional dos mineiros. Inalação de poeira contendo S1O2 , ocorre a silicose, sob a ação do pó de alumínio - aluminose. De acordo com o conteúdo no corpo humano (10-6-10-5%) o germânio é um microelemento. O papel biológico não foi totalmente elucidado. Os compostos de germânio melhoram os processos de hematopoiese na medula óssea. Sabe-se também que os compostos de germânio apresentam baixa toxicidade. De acordo com o conteúdo no corpo humano (104 %) estanho refere-se a oligoelementos. O estanho entra no corpo humano com alimentos ácidos conservados em latas revestidas com uma camada de estanho. Em um ambiente ácido, o estanho se dissolve e entra no sangue na forma de um sal, exibindo um efeito tóxico. No entanto, em experimentos com ratos, verificou-se que o estanho em pequenas quantidades tem um efeito estimulante no crescimento de ratos. Isso dá razão para supor sua necessidade para os seres humanos. Sem dúvida, a elucidação do papel biológico deste microelemento requer mais estudos. Na prática médica, vários materiais são usados, em particular materiais de enchimento contendo estanho. Assim, o estanho faz parte do amálgama de prata (28%) para a fabricação de obturações. O chumbo e seus compostos, principalmente os orgânicos, são altamente tóxicos. Os compostos de chumbo afetam a síntese de proteínas, o balanço energético celular e seu aparato genético. Muitos fatores falam a favor de um mecanismo de desnaturação. Foi estabelecido que o chumbo é um dos elementos cuja presença nos alimentos afeta o desenvolvimento de cáries. Com comida, água, ar atmosférico, uma pessoa absorve diariamente até 100 microgramas de chumbo. O chumbo é depositado principalmente no esqueleto (até 90%) na forma de fosfato pouco solúvel. A fração de massa de chumbo no corpo humano é de 106%־. Uma ingestão diária de 0,2-2 mg de chumbo é considerada segura para humanos. Na prática médica, acetato de chumbo (loções) e óxido de chumbo (II) PbO (parte do adesivo de chumbo simples) encontraram aplicação como anti-séptico adstringente externo. 49. Papel biológico dos elementos p do grupo VA. O uso de seus compostos na medicina (nitrogênio, fósforo) O teor de nitrogênio no corpo humano (3,1%) refere-se a macronutrientes. Se levarmos em conta apenas a massa de matéria seca do corpo (sem água), o teor de nitrogênio nas células é de 8 a 10%. Este elemento é parte integrante de aminoácidos, proteínas, vitaminas, hormônios. O nitrogênio forma ligações polares com átomos de hidrogênio e carbono em biomoléculas. Em muitos complexos bioinorgânicos (metaloenzimas), os átomos de nitrogênio ligam as partes inorgânicas e orgânicas da molécula pelo mecanismo doador-aceptor. Juntamente com o oxigênio e o carbono, o nitrogênio forma compostos vitais - aminoácidos contendo um grupo amino com propriedades básicas e um grupo carboxila (-COOH) com propriedades ácidas. O grupo amino também desempenha uma função muito importante nas moléculas de ácido nucléico. O significado fisiológico dos bioligandos contendo nitrogênio - porfirinas, como a hemoglobina, é enorme. O ciclo do nitrogênio ocorre na biosfera. O ciclo do nitrogênio é vital para a agricultura. É necessário observar mais uma propriedade biologicamente importante do nitrogênio - sua solubilidade em água é quase a mesma do oxigênio. A presença de excesso de nitrogênio no sangue pode ser a causa do desenvolvimento da doença descompressiva. Com o rápido aumento dos mergulhadores, ocorre uma queda acentuada na pressão, a solubilidade do nitrogênio no sangue diminui de acordo (lei de Henry) e as bolhas de nitrogênio elementar que saem do sangue entopem os pequenos vasos, o que pode levar à paralisia e à morte. De acordo com o conteúdo no corpo humano (0,95%), o fósforo pertence aos macronutrientes. O fósforo é um elemento organogênico e desempenha um papel extremamente importante no metabolismo. Na forma de fosfato, o fósforo é um componente essencial do ATP intracelular. Faz parte das proteínas (0,5-0,6%), ácidos nucléicos, nucleotídeos e outros compostos biologicamente ativos. O fósforo é a base do esqueleto de animais e humanos (ortofosfato de cálcio, hidroxiapatita), dentes (hidroxiapatita, fluorapatita). Muitas reações biossintéticas são realizadas devido à transferência de grupos fosfato de um aceptor de alta energia para um de baixa energia. O sistema tampão fosfato é um dos principais sistemas tampão no sangue. Os organismos vivos não podem prescindir do fósforo. A importância do fósforo está no fato de que açúcares e ácidos graxos não podem ser utilizados pelas células como fontes de energia sem fosforilação prévia. A troca de fósforo no corpo está intimamente relacionada à troca de cálcio. Isso é confirmado por uma diminuição na quantidade de fósforo inorgânico com um aumento no teor de cálcio no sangue (antagonismo). A necessidade humana diária de fósforo é de 1,3 g.O fósforo é tão difundido em produtos alimentícios que os casos de sua deficiência aparente (falta de fosfato) são praticamente desconhecidos. No entanto, nem todo o fósforo contido nos produtos alimentícios pode ser absorvido, pois sua absorção depende de muitos fatores: pH, proporção entre cálcio e fósforo nos alimentos, presença de ácidos graxos nos alimentos, mas antes de tudo, no conteúdo de vitamina D. Vários compostos de fósforo são usados como medicamentos. Deve-se notar que compostos organofosforados contendo a ligação C-P são fortes venenos nervosos e fazem parte de agentes de guerra química. 50. Papel biológico dos elementos p do grupo VA (arsênico, antimônio, bismuto). Seu uso na medicina De acordo com o conteúdo no corpo humano, o arsênico pertence aos oligoelementos. Concentra-se no fígado, rins, baço, pulmões, ossos, cabelo. A maior parte do arsênico é encontrado no tecido cerebral e nos músculos. O arsênico se acumula nos ossos e cabelos e não é completamente removido deles por vários anos. Esse recurso é usado em exames forenses para esclarecer a questão de saber se houve envenenamento com compostos de arsênico. A determinação de arsênio em material biológico é realizada em um dispositivo simples de acordo com a reação de Marsh: zinco e ácido clorídrico são adicionados ao objeto biológico. O hidrogênio liberado durante a reação reduz qualquer composto de arsênico a arsina. Se o hidrogênio liberado contém uma mistura de arsina, então o AsH se decompõe quando a mistura gasosa é aquecida3 : 2AsH3 = 2As° + 3H2. e nas paredes do tubo para a evolução do gás é formado um revestimento preto brilhante de arsênico - um "espelho de arsênico". A reação de Marsh é muito sensível e pode detectar 7-107 g arsênico. Em doses relativamente grandes, os compostos de arsênico são muito tóxicos. Como já mencionado, o efeito tóxico dos compostos de arsênico é devido ao bloqueio de grupos sulfidrila de enzimas e outras substâncias biologicamente ativas. De acordo com o conteúdo no corpo humano (10%), o antimônio e o bismuto são microelementos. Segundo a classificação de V. V. Kovalsky, o antimônio e o bismuto pertencem ao grupo de microelementos constantemente encontrados nos organismos vivos, mas cujo papel fisiológico e bioquímico praticamente não é claro. O papel fisiológico do antimônio é obviamente semelhante ao do arsênico. Íons de arsênio As e antimônio Sb e, em menor grau, bismuto Bi são sinergistas. Assim, sabe-se que em províncias biogeoquímicas com excesso de arsênico nos organismos, o conteúdo não apenas de arsênico, mas também de antimônio aumenta. Ao mesmo tempo, ambos os elementos se acumulam na glândula tireóide dos habitantes, inibem sua função e causam bócio endêmico. O sinergismo do arsênio e do antimônio está associado à sua capacidade de formar compostos com ligantes contendo enxofre. O bismuto é mais propenso a se ligar a ligantes contendo grupos amino. Assim, a entrada de compostos solúveis de bismuto no corpo leva à inibição das enzimas amino e carboxipolipeptidase. A ingestão de compostos de antimônio solúveis em água, como a estibina SbH3, tem um efeito tóxico semelhante aos compostos de arsênio. Os compostos de bismuto também são tóxicos quando injetados. Por exemplo, para cães, a dose letal é de 6 mg/kg de peso corporal. No entanto, quando a maioria dos compostos de antimônio e bismuto entram no trato digestivo, eles praticamente não têm efeito tóxico. A fraca toxicidade desses compostos se deve ao fato de que os sais de Sb(III), Bi(III) no trato digestivo sofrem hidrólise com a formação de produtos pouco solúveis que não são absorvidos pelas paredes do trato gastrointestinal. Esta é a base para o uso de drogas de antimônio e bismuto, por exemplo, nitrato de bismuto básico. 51. Papel biológico dos elementos p do grupo VIA. O uso de seus compostos na medicina De acordo com o conteúdo no corpo humano (62%), o oxigênio pertence aos macronutrientes. É indispensável e é um dos elementos mais importantes que formam a base dos sistemas vivos, ou seja, é um organógeno. O oxigênio faz parte de um grande número de moléculas, desde as mais simples até os biopolímeros. O papel do oxigênio nos processos vitais é grande, pois a oxidação de nutrientes (carboidratos, proteínas, gorduras) com o oxigênio serve como fonte de energia necessária para o funcionamento dos órgãos e tecidos dos organismos vivos. A maioria das reações redox no corpo ocorre com a participação do oxigênio e suas formas ativas. As funções fagocíticas (protetoras) do corpo também estão associadas à presença de oxigênio, e uma diminuição no teor de oxigênio no corpo diminui suas propriedades protetoras. Nos fagócitos (células capazes de capturar e digerir corpos estranhos), o oxigênio 02 é reduzido a superóxido. Na prática médica, o oxigênio é usado para inalação em condições dolorosas acompanhadas de deficiência de oxigênio (hipóxia), doenças do trato respiratório, sistema cardiovascular, envenenamento por monóxido de carbono (II) CO, ácido cianídrico HCN, bem como doenças com funções respiratórias prejudicadas . Muito utilizada na prática clínica é a oxigenação hiperbárica - o uso de oxigênio sob alta pressão. A modificação alotrópica de oxigênio - ozônio O3 como um agente oxidante muito forte é usado para desinfecção de instalações, desinfecção do ar e purificação de água potável. De acordo com o conteúdo no corpo humano (0,16%), o enxofre pertence aos macronutrientes. Como o oxigênio, é vital. A necessidade diária de enxofre para um adulto é de cerca de 4-5 G. O enxofre faz parte de muitas biomoléculas - proteínas, aminoácidos (cistina, cisteína, metionina, etc.), hormônios (insulina), vitaminas (vitamina B1). Muito enxofre é encontrado no caroteno do cabelo, ossos, tecido nervoso. Nos organismos vivos, o enxofre, que faz parte dos aminoácidos, é oxidado. Os produtos finais deste processo são predominantemente sulfatos. Além disso, são formados tiossulfatos, enxofre de cimento e ácidos politiônicos. De acordo com o conteúdo no corpo (10-5-10-7%) o selênio é um microelemento. Alguns pesquisadores o consideram um elemento vital. O selênio vem dos alimentos - 55-110 mg por ano. O selênio concentra-se principalmente no fígado e nos rins. A concentração de selênio no sangue é de 0,001-0,004 mmol / l. A conexão do selênio com o enxofre nos organismos vivos é inquestionável. Em altas doses, o selênio se acumula principalmente nas unhas e cabelos, que são baseados em aminoácidos contendo enxofre. A capacidade do selênio de proteger o corpo do envenenamento com mercúrio Hg e cádmio Cd também é conhecida. O selênio promove a ligação desses metais tóxicos a outros centros ativos, àqueles que não são afetados por seu efeito tóxico. Um fato interessante é a relação entre o alto teor de selênio na dieta e a baixa mortalidade por câncer. O selênio é tóxico em altas doses. A quebra de compostos de selênio em animais leva à liberação de dimetil selênio altamente tóxico, que tem odor de alho. 52. Papel biológico dos elementos p do grupo VIIA. O uso de seus compostos na medicina (flúor e cloro) De acordo com o conteúdo do corpo humano, o cloro (0,15%) pertence aos macroelementos, enquanto os demais elementos deste grupo são microelementos (teor - 105 %). Os halogênios na forma de vários compostos fazem parte dos tecidos de humanos e animais. O cloro e o iodo são elementos insubstituíveis, enquanto o resto são constituintes permanentes dos tecidos. A massa de flúor no corpo humano é de cerca de 7 mg (~105 %). Os compostos de flúor estão concentrados no tecido ósseo, unhas, dentes. A composição dos dentes inclui cerca de 0,01% de flúor, e a maior parte cai no esmalte, o que está associado à presença de fluorapatita pouco solúvel nele. A falta de flúor no organismo leva à cárie dentária. O interesse pela ação biológica do flúor está associado principalmente ao problema das doenças dentárias, uma vez que o flúor protege os dentes da cárie. A base mineral dos tecidos dentários (dentina) é a hidroxiapatita, clorapatita e fluorapatita. Muitas vezes, não a superfície externa do dente, coberta com uma camada de esmalte, é submetida à destruição, mas as partes internas da dentina, expostas quando o esmalte é danificado. Há sugestões de que enquanto o esmalte está levemente danificado, a introdução de fluoreto de sódio promove a formação de fluorapatita, facilitando a remineralização do dano iniciado. O fluoreto de sódio NaF é usado na prática médica como agente externo tópico. O uso de NaF é baseado na formação de fluorapatita. Ao mesmo tempo, ocorre também a alcalinização do ambiente da cavidade oral, o que contribui para a neutralização dos ácidos produzidos pelas bactérias. Não só a falta, mas também o excesso de flúor é prejudicial. Quando o teor de flúor na água potável está acima da taxa máxima permitida (1,2 mg/l), o esmalte dos dentes torna-se quebradiço, facilmente destruído e aparecem outros sintomas de intoxicação crônica por flúor - aumento da fragilidade óssea, deformidades ósseas e exaustão geral do corpo. A doença que ocorre neste caso é chamada de fluorose (fluorose). O corpo humano contém cerca de 100 g (2790 mmol) de cloro. Cloridions desempenham um papel biológico importante. Eles ativam algumas enzimas, criam um ambiente favorável para a ação de enzimas protolíticas do suco gástrico, fornecem fluxos de íons através das membranas celulares e participam da manutenção do equilíbrio osmótico. Cloridion tem um raio ideal para penetração através da membrana celular. Isso explica sua participação conjunta com íons Na e K na criação de uma certa pressão osmótica e na regulação do metabolismo água-sal. A necessidade diária de cloreto de sódio é de 5 a 10 g. Conforme já discutido, o NaCl é necessário para a produção de ácido clorídrico no estômago. Além do importante papel do ácido clorídrico no processo de digestão, destrói várias bactérias patogênicas (cólera, febre tifóide). Se as bactérias entrarem no estômago com uma grande quantidade de água, devido à diluição do HCl, não terá efeito antibacteriano e as bactérias sobreviverão. Isso leva a doenças no corpo. Portanto, durante as epidemias, a água bruta é especialmente perigosa. Com uma quantidade insuficiente de ácido clorídrico no estômago, o pH aumenta e a digestão normal é perturbada, o que afeta seriamente a saúde humana. Com acidez reduzida do suco gástrico, uma solução diluída de ácido clorídrico é usada na prática médica. Com inflamação do estômago (gastrite), úlcera péptica, a secreção de suco gástrico aumenta, sua acidez aumenta. 53. Papel biológico dos elementos p do grupo VIIA. O uso de seus compostos na medicina (bromo, iodo) A massa de bromo no corpo humano é de cerca de 7 mg. Localiza-se principalmente nas glândulas endócrinas, principalmente na glândula pituitária. O papel biológico dos compostos de bromo no funcionamento normal do organismo ainda não foi suficientemente elucidado. Os compostos de bromo inibem a função da glândula tireóide e aumentam a atividade do córtex adrenal. Quando bromídios são introduzidos no corpo, o sistema nervoso central é o mais sensível. Os bromídios se acumulam uniformemente em várias partes do cérebro e agem calmamente com maior excitabilidade. Eles contribuem para a restauração do equilíbrio perturbado entre os processos de excitação e inibição. Bromidions são facilmente absorvidos no trato gastrointestinal. A toxicidade dos bromídios é baixa. Devido à excreção lenta do corpo (dentro de 30 a 60 dias), eles podem se acumular (acumular), o que leva ao desenvolvimento de envenenamento crônico, chamado bromismo. Se surgirem sinais de intoxicação crônica por bromo, as preparações de brometo devem ser imediatamente descontinuadas. Além disso, uma grande quantidade de cloreto de sódio é administrada (até 25 g por dia) para aumentar a taxa de liberação de bromídios (princípio de Le Chatelier) e uma bebida abundante é prescrita. Devido a diferentes sensibilidades individuais, a dosagem das preparações de bromo varia de 0,05 a 2,0 g. O iodo é um dos elementos biogênicos essenciais e seus compostos desempenham um papel importante nos processos metabólicos. O iodo afeta a síntese de certas proteínas, gorduras, hormônios. O corpo humano contém cerca de 25 mg de iodo. Da quantidade total de iodo no corpo, mais da metade está na glândula tireóide. Quase todo o iodo contido nesta glândula está em estado ligado (na forma de hormônios) e apenas cerca de 1% dele está na forma de iodidiona. A glândula tireóide é capaz de concentrar I-25 vezes - em comparação com seu conteúdo no plasma. A glândula tireoide secreta os hormônios tiroxina e triiodotironina. Uma glândula tireoide hipoativa (hipotireoidismo) pode estar associada a uma diminuição em sua capacidade de acumular íons de iodeto, bem como à falta de iodo na dieta (bócio endêmico). Com bócio endêmico, as preparações de iodo são prescritas: (iodeto de potássio KI ou iodeto de sódio NaI) em doses correspondentes à necessidade humana diária de iodo (0,001 g de iodeto de potássio). Em áreas onde há deficiência de iodo, NaI ou K é adicionado ao sal de mesa para prevenir o bócio endêmico! (1-2,5 g por 100 kg). Com o aumento da atividade da glândula tireóide (hipertireoidismo), devido à síntese excessiva de hormônios tireoidianos, observa-se uma taxa anormalmente aumentada de processos metabólicos. Com a ineficácia desses medicamentos para o tratamento do hipertireoidismo, é utilizada uma preparação de iodo radioativo 131 I, cuja radiação destrói os folículos da glândula tireóide e, assim, reduz o excesso de síntese de hormônios. Todos os elementos do grupo VIIA são fisiologicamente ativos, sendo o cloro e o iodo indispensáveis para a atividade vital do organismo. O flúor é considerado um elemento necessário para o funcionamento normal dos organismos vivos. No corpo, os halogênios são intercambiáveis, sendo observados casos de sinergia e antagonismo. 54. Aerossóis Os aerossóis são sistemas dispersos com um meio de dispersão gasoso. Dependendo do estado de agregação da fase dispersa, distinguem-se os nevoeiros - aerossóis com fase líquida dispersa; fumaça, poeira - aerossóis com fase sólida dispersa; smog - aerossóis com uma fase dispersa mista. Os tamanhos de partículas da fase dispersa de aerossóis, de acordo com a classificação de sistemas dispersos, variam de 107 para 109 m Como outros sistemas dispersos, os aerossóis são obtidos por dois métodos: condensação e dispersão. método de condensação A fase dispersa é obtida a partir da fase de vapor pelo processo físico de condensação de moléculas em partículas de tamanho coloidal. Métodos de dispersão Partículas de tamanhos coloidais são obtidas por moagem de agregados maiores. Os aerossóis têm a capacidade de dispersar a luz. As partículas da fase dispersa dos aerossóis não possuem uma dupla camada elétrica, mas as partículas da fase dispersa muitas vezes carregam uma carga elétrica. A carga surge como resultado do atrito ou devido à adsorção de íons de gás. Deve-se notar que muitas vezes as partículas de aerossol (pequenas e grandes) carregam uma carga de sinal oposto. A separação de partículas por tamanho em grandes volumes de aerossóis ao longo da altura pode levar ao aparecimento de um campo elétrico de alta intensidade. Assim, ocorre uma descarga elétrica nas nuvens - um raio. Os aerossóis são sistemas cinética e agregativamente instáveis, uma vez que não há dupla camada elétrica no limite de fase. Portanto, os aerossóis coagulam mais rapidamente que os liossóis. Na medicina, os aerossóis são usados na terapia de inalação, para proteger a pele danificada, desinfecção. Às vezes, a formação de aerossóis é altamente indesejável. Os aerossóis perigosos para a saúde humana são formados nas indústrias de fundição, cerâmica, durante a extração e processamento de vários minerais (minério, carvão, amianto, etc.). Aerossóis contendo partículas de carvão causam doenças pulmonares - antracose, óxido de silício (IV) - silicose, amianto - asbestose. As doenças alérgicas são causadas por aerossóis formados por pólen vegetal, poeira gerada durante o processamento de algodão, linho, cânhamo, etc. Suspensões de bactérias, mofo e vírus - aerossóis microbiológicos ou bacterianos - são uma das formas de transmissão de doenças infecciosas: tuberculose pulmonar, gripe, doenças respiratórias agudas. Efeitos nocivos no corpo humano são produzidos por aerossóis formados durante a combustão de combustível, cuja fase dispersa consiste em fuligem, alcatrão, cinzas e hidrocarbonetos cancerígenos. Smogs são especialmente perigosos para a saúde. Portanto, a luta contra a poeira e a poluição da atmosfera está se tornando cada vez mais importante. A purificação do ar a partir de aerossóis é alcançada pela introdução de tecnologias sem desperdício - capturando partículas da fase dispersa usando filtros, ciclones (coletores de pó centrífugos) e um campo elétrico de alta voltagem. 55. Emulsões Emulsões são sistemas microheterogêneos em que a fase dispersa e o meio de dispersão são líquidos imiscíveis. Os tamanhos das partículas da fase dispersa - gotículas líquidas - variam de 104 a 106 m. Dependendo da concentração da fase dispersa, as emulsões são diferenciadas: diluídas, concentradas e altamente concentradas. Dependendo da natureza da fase dispersa e do meio de dispersão, existem: 1) emulsões de um líquido apolar (DF) em um líquido polar (DS) - emulsões diretas, chamadas emulsões do primeiro tipo ou emulsões do tipo "óleo / água" (O / W); 2) emulsões de um líquido polar (DF) em um apolar (DS) - emulsões inversas, chamadas emulsões de segundo tipo ou emulsões do tipo "água / óleo" (A / O). Aqui, DF e DS são a fase dispersa e o meio de dispersão, respectivamente, "água" é qualquer líquido polar, "óleo" é apolar. O tipo de emulsão pode ser definido: 1) medição de condutividade elétrica; 2) mistura com excesso de líquido polar ou não polar; 3) coloração com corantes solúveis em água ou solúveis em óleo; 4) molhando e espalhando uma gota de emulsão sobre uma superfície hidrofóbica ou hidrofílica. As emulsões, como outros sistemas dispersos, podem ser obtidos por métodos de condensação e dispersão. Emulsões como dispersões grosseiras são sistemas cinética e agregativamente instáveis. Quando as gotículas da fase dispersa colidem, elas se fundem (coalescência). Como resultado da coalescência, a emulsão se separa em duas fases líquidas contínuas. Os emulsificantes são usados para aumentar a estabilidade das emulsões. Estes são surfactantes que, como resultado da adsorção no limite de fase, reduzem o valor da tensão interfacial e formam um filme de adsorção mecanicamente forte. Se o emulsificante for um surfactante iônico, ele transmite uma carga elétrica de mesmo sinal às gotículas da fase dispersa, e as gotículas se repelem. O tipo de emulsão formada depende das propriedades do emulsificante. O meio de dispersão é sempre o líquido que melhor dissolve ou molha o emulsificante. Sais de ácidos graxos superiores, ésteres de ácidos graxos superiores e álcoois poli-hídricos, aminas de cadeia longa são usados como emulsificantes. As emulsões são amplamente encontradas na natureza. As emulsões são leite, creme, creme de leite, manteiga, gema de ovo, suco de plantas leitosas, óleo cru. As emulsões contendo substâncias medicinais são amplamente utilizadas na medicina: o primeiro tipo (O/W) para uso interno, o segundo tipo (W/M) para uso externo. Sabe-se que as gorduras vegetais e animais são melhor absorvidas pelo organismo na forma emulsificada (leite). Neste caso, os derivados dos ácidos cólico e desoxicólico atuam como emulsificantes. Às vezes, é necessário quebrar a emulsão resultante. A quebra de uma emulsão é chamada de desemulsificação. A desemulsificação é realizada aumentando e diminuindo a temperatura, exposição a um campo elétrico, centrifugação, adição de eletrólitos e substâncias especiais - desemulsificantes. Os desemulsificantes são surfactantes com maior atividade de superfície do que os emulsificantes, mas não têm a capacidade de formar uma camada de adsorção mecanicamente forte. 56. Tensoativos coloidais Os tensoativos coloidais são substâncias que, com o mesmo solvente, dependendo das condições, formam uma solução verdadeira e coloidal. Como já mencionado, as moléculas de surfactante são anfifílicas. Eles consistem em grupos apolares e polares. Radicais apolares, por exemplo, cadeias de hidrocarbonetos, não têm afinidade com o solvente polar - água, para grupos polares é bastante alta. Há uma interação hidrofóbica (van der Waals) entre grupos apolares. Com um comprimento de corrente de aproximadamente 1022 átomos de carbono devido a interações hidrofóbicas de radicais de hidrocarbonetos e forte interação de grupos polares com água, moléculas de surfactantes são associadas e micelas são formadas. A concentração mínima de um tensoativo coloidal, a partir da qual se formam micelas em sua solução, é chamada de concentração micelar crítica (CMC). A forma das micelas resultantes depende da concentração da solução. Em baixas concentrações de surfactante coloidal, são formadas micelas esféricas. Um aumento na concentração de uma solução de tensoativo coloidal primeiro leva a um aumento em seu número e depois a uma mudança na forma. Em concentrações mais altas, em vez de micelas esféricas, são formadas micelas cilíndricas e lamelares. O valor de CMC depende de vários fatores: a natureza do tensoativo coloidal, temperatura e a presença de impurezas de substâncias estranhas, especialmente eletrólitos. A CMC pode ser determinada pelas propriedades da solução, que dependem do número e tamanho das partículas cineticamente ativas, em particular, por mudanças na pressão osmótica, tensão superficial, condutividade elétrica e características ópticas. Como o tamanho das partículas cineticamente ativas (íons, moléculas, micelas) e seu número mudam durante a transição "solução verdadeira - solução coloidal", um ponto de quebra correspondente ao CMC aparece no gráfico "propriedade - concentração". Uma das propriedades mais importantes das soluções tensoativas coloidais, devido às quais são amplamente utilizadas em diversos setores da economia nacional e na medicina, é a solubilização. O mecanismo de solubilização consiste na dissolução de substâncias apolares no núcleo hidrofóbico das micelas. O fenômeno da solubilização é amplamente utilizado em diversos setores da economia nacional: na indústria alimentícia, na indústria farmacêutica (para obtenção de formas líquidas de substâncias medicinais). No sistema "água - fosfolipídeo", agitação e agitação formam micelas esféricas - lipossomas. As moléculas de fosfolipídios formam uma membrana de bicamada nos lipossomas, na qual os grupos polares estão voltados para a água e os apolares estão voltados uns para os outros. Os lipossomas podem ser considerados como um modelo de membranas biológicas. Eles podem ser usados para estudar a permeabilidade das membranas e a influência de vários fatores sobre ela para vários compostos. Os lipossomas são amplamente utilizados para a entrega direcionada de medicamentos a certos órgãos ou áreas afetadas. Os lipossomas podem transportar drogas para as células. As membranas lipossômicas são usadas em estudos imunológicos para estudar a interação entre anticorpos e antígenos. Autores: Drozdova M.V., Drozdov
▪ Psicologia Geral. Notas de aula ▪ Direito do trabalho da Federação Russa. Berço ▪ Dinheiro. Crédito. Bancos. Notas de aula
Couro artificial para emulação de toque
15.04.2024 Areia para gatos Petgugu Global
15.04.2024 A atratividade de homens atenciosos
14.04.2024
▪ seção do site Manual do Eletricista. Seleção de artigos ▪ artigo Estudar, estudar e estudar. expressão popular ▪ artigo Contra qual marco 300 figuras da cultura francesa escreveram um protesto? Resposta detalhada ▪ artigo Bocal e cigarro. Segredo do foco
Página principal | Biblioteca | Artigos | Mapa do Site | Revisões do site www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Veja outros artigos seção
Veja outros artigos seção 